2023年6月,BioNTech在美国临床肿瘤学会(ASCO)上公布了BNT211的首个人体试验数据。BNT211一种针对 Claudin-6 (CLDN6) 的CAR-T和mRNA疫苗的联合疗法,包含了靶向CLDN6的自体CAR-T及CLDN6编码的纳米颗粒mRNA疫苗CARVac。mRNA疫苗通过在抗原呈递细胞表面表达CLDN6来刺激体内CAR-T细胞的进一步扩增,从而增强其疗效。结合最新公布的研究数据,研究人员表示,CLDN6 CAR-T单独或与 CARVac 联合输注都是安全的,并且对 CLDN6 阳性癌症患者显示出疗效,其结果优于其他实体瘤 CAR T 试验的数据。那CLDN6会是继ClDN18.2之后的下一个实体瘤治疗的新兴靶点吗?与其他靶点相比,它有哪些优势?目前的靶向药的竞争格局又是如何?
1、CLDN6是什么?
紧密连接蛋白6(CLDN6)是紧密连接蛋白(Claudins,CLDNs)家族的成员之一。1998年,Furuse Mikio首次从鸡肝中克隆出一种相对分子质量约为22kDa的蛋白质,分别将其命名为claudin-1(211 AA)和claudin-2 (230 AA) d蛋白[1]。目前已发现27种Claudin家族成员,其中24个在哺乳动物中表达。claudins主要在内皮细胞或上皮细胞中以组织特异性方式表达。根据不同claudins的序列同源性的高低可以将这些成员分为两类,分别是经典型和非经典型claudins。claudins是紧密连接(tight junctions, TJ)中一种具有代表性的跨膜蛋白家族,是构成TJ的主要结构,主要作用是维持TJ特有的栅栏和屏障功能。
CLDN6属于经典型claudins,与CLDN1、CLDN2、CLDN3、CLDN4、CLDN5、CLDN7、CLDN8、CLDN9、CLDN10、CLDN14、CLDN15、CLDN17和CLDN19同源 [2]。2001年,Turksen K.从分化胚状体(EB)的差异显示分析中鉴定出CLDN6。但是,Turksen K.并不是分离CLDN6的第一人。CLDN6 cDNA最早是在1995年由Harrison S.M.团队从外胚层特异性文库中分离出来的[3] [4]。
CLDN6的表达受多种因素动态调节。CLDN6一般在胃、胰腺、肺、肾等胎儿组织中表达,但在相应的成人组织样本中不表达 [5]。CLDN6 是胚胎干(ES) 细胞中最早表达的上皮命运决定蛋白之一,也是人类多能干细胞 (hPSC) 的细胞表面特异性标记物 [6]。
2、CLDN6的结构与功能?
人的CLDN6基因位于染色体16p13.3上,由220个氨基酸组成,分子量为23kDa,包含三个外显子。如图1所示,与其他CLDN一致,CLDN6具有四个跨膜结构域、一个短的胞质N端、一个C端胞质结构域、两个胞外结构域(较大的ECL1和一个较小的ECL2)和一个短的胞内环。ECL1和细胞质C末端的PDZ结合域是CLDN的典型结构域。ECL1 在细胞之间交叉形成离子选择性孔。不同claudins ECL1区上氨基酸位置和所带电荷都有很大差异,C末端序列的不同也是区分claudin各个成员的另外一个差异点。C末端的PDZ结合序列和一些潜在的磷酸化位点能够使claudin与胞质内含PDZ结构的ZO-1、ZO-2、ZO-3、MUPP1等直接作用于其特定的结构域,ZO-1、ZO-2又可直接与肌动蛋白丝相连,从而使TJ蛋白与细胞内骨架结构形成稳定的系统。
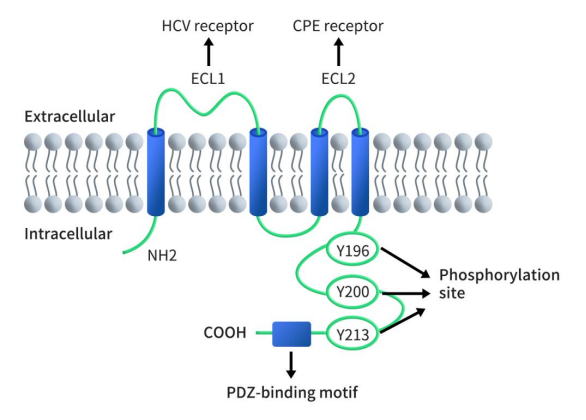
Figure 1. The structure of CLDN6 [5]
作为claudin蛋白家族成员之一,CLDN6也具有紧密连接的渗透性调节和屏障形成功能。关于渗透性调节功能,CLDN6对于新生儿肾近端小管的氯离子渗透性调节和内耳淋巴囊上皮的离子转运调节至关重要 [7] [8]。在屏障方面,CLDN6对于维持肺上皮屏障很重要。此外,CLDN6主要参与早产时表皮渗透屏障(EPB)的形成。与其他claudin成员不同的是,CLDN6是唯一具有潜在特异性的CLDN,因为它可以激活细胞粘附信号并调节核受体的活性。CLDN6可受刺激和转录因子、DNA甲基化、磷酸化和棕榈酰化的调节。
3、CLDN6与实体瘤
肿瘤细胞常常表现为细胞间紧密连接丧失,这也可能是肿瘤转移发展进程中重要一步。紧密连接蛋白渗透功能的改变将导致更多的营养物质和其他因子渗入供肿瘤生长。作为紧密连接的主要结构,Claudins的异常表达可导致上皮细胞、内皮细胞的结构破坏及功能受损,其在多种上皮来源的肿瘤中异常表达。比如Cliaudin2在前列腺癌、乳腺癌中,Claudin3在肾癌、膀胱癌中,Claudin4在肾癌、肝癌中的表达均是下调的。与其他CLDN不同的是,CLDN6是一种肿瘤特异性蛋白,存在于多种实体肿瘤中,包括卵巢、子宫内膜、肺、胃和睾丸,但在健康的成人组织中不存在。基于此,近年来关于CLDN6在癌症中作用的研究越来越多。随着研究结果的不断披露,CLDN6也逐步成为了肿瘤治疗的理想靶点。
关于作用机制,目前还没有一个公认的经典途径,以CLDN6在乳腺癌中的作用为例:吉林大学全成实教授团队的一项研究证实,CLDN6的下调是通过DNA甲基转移酶1(DNMT1)介导的DNA甲基化来调节的,而DNMT1依赖于SMAD2通路。通过下调DNMT1表达抑制CLDN6甲基化可抑制乳腺癌细胞的上皮向间充质转移(EMT)、迁移和侵袭 [9]。在此项研究之前,全教授团队的研究也证明claudin-6基因沉默可增强乳腺癌细胞增殖和迁移,同时通过p38 MAPK 信号通路增加 MMP-2 活性,进一步促进人类乳腺癌的恶性进展 [10]。此外,还有多项研究提示乳腺癌细胞中CLDN6的表达会受到多条信号通路调节,包括HIF-1α通路 [11]、ASK1-p38/c-Jun N通路[12]和 (Erβ)/Erα-Beclin1通路 [13]。
4、CLDN6靶向药研究进展
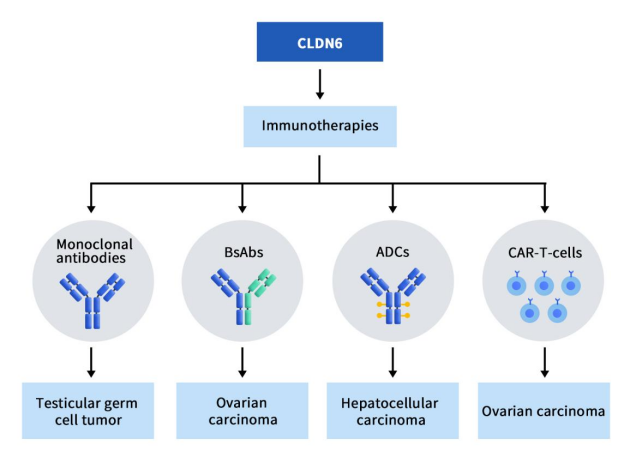
CLDN6 研究用于治疗癌症的新兴免疫疗法,包括单克隆抗体、双特异性抗体 (BsAb)和抗体药物偶联物 (ADC)。目前已上临床的项目共计7项,单抗1项,双抗2项,ADC药物2项,CAR-T疗法2项。
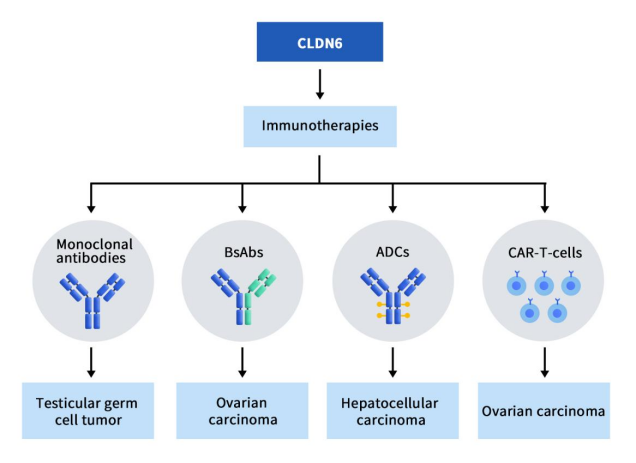
Figure 2. The types of drugs targeting CLDN6 [5]
4.1 ASP1650
ASP1650是安斯泰来开发的一款靶向CLDN6的嵌合小鼠/人类IgG1抗体,当前处于II期临床。该单抗药是目前进展最快的CLDN6单克隆抗体,但也是最早因临床结果不理想而终止的项目。2022年公开的的II期临床结果表明,ASP1650在复发/难治性睾丸生殖细胞肿瘤(GCT)患者(19名男性)中没有显示出具有临床意义的单药活性,目前该管线已停止开发 [14]。
4.2 BNT211&BNT142
德国药企BioNTech在2023年ASCO年会上公布了其CLDN产品组合的多项更新,包括BNT211和BNT142。其中,最引人注目的是治疗实体瘤的BNT211最新研究结果。
BNT211包含两个部分,一部分是靶向CLDN-6的自体CAR-T细胞疗法,另一部分是基于BioNTech专有mRNA-lipoplex技术开发的CLDN6编码mRNA疫苗(CARVac)。该疗法旨在诱导针对各种 CLDN6阳性实体瘤的强大免疫反应,例如卵巢癌、肉瘤、睾丸癌、子宫内膜癌和胃癌。目前,BNT211 正在 CLDN6阳性复发/难治性晚期实体瘤患者中加入或不加入 CARVac 联合进行 1/2 期试验。最新结果表明,在CLDN6阳性复发/难治性晚期实体瘤患者中,加入或不加入CLDN6编码mRNA疫苗CARVac,都展示出积极的活性和可控的安全性数据。截至2023年3月,在接受BNT211联合或不联合CARVac治疗的17名可评估患者中,总体客观缓解率(ORR)为41%,疾病控制率(DCR)达到65%。其中1名接受自动化BNT211治疗的睾丸癌患者获得手术完全缓解(sCR)。还有5名患者达到部分缓解(PR),3名患者达到病情稳定(SD)。在自动化工艺制造的过程中,BNT211维持了疗效,这对扩大生产过程提供了支持 [15]。
BNT142是编码CD3 x CLDN6双特异性的mRNA疫苗。静脉注射后,BNT142被引导至肝脏,两种RNA在肝脏中被翻译、组装并作为抗体分泌到循环中。由于mRNA疫苗毒性容易在肝脏内蓄积,因此肝毒性的报告具有重要意义。目前BNT142正在进行临床I期剂量递增临床试验。
4.3 TORL-1-23
TORL-1-23是由TORL BioTherapeutics开发的由抗CLDN6单抗与微管蛋白抑制剂MMAE通过可切割连接子偶联生成的抗体偶联药物(ADC)。体外实验表明,TORL-1-23具有高度选择性,它能选择性的与CLDN6过表达细胞系强力结合,而不与其他紧密蛋白过表达细胞系结合,如CLDN3、CLDN4 和 CLDN9。ASCO年会上公布的TORL-1-23 临床I期试验结果显示,在25位平均接受过5种前期治疗的难治性癌症患者中,28%的患者获得确认缓解。该公司计划招募更多CLDN6阳性卵巢癌和非小细胞肺癌患者,并且在决定2期临床推荐剂量之后扩展到其它CLDN6阳性癌症类型。
4.4 DS-9606
DS-9606是由Daiichi Sankyo基于苯并二氮卓衍生物(PBD)构建的靶向CLDN6 ADC药物。临床前研究数据结果显示,此技术平台构建的靶向Claudin6 ADC表现出显著的抗肿瘤活性。目前DS-9606正在开展临床1期研究,这项研究旨在评估DS-9606a在晚期实体瘤患者中的安全性和耐受性。该研究的次要目标将评估DS-9606a的药代动力学特性,研究DS-9606a的反应持续时间和无进展生存期,并评估DS-9606a的免疫原性。
4.5 CLDN6-CAR-NK cell therapy
CLDN6-CAR-NK cell therapy是一项目前正在广州医科大学第二附属医院开展的1/2期临床实验,暂时还未公布任何结果。该项实验选择具有Claudin6表达的晚期癌症患者,对患者进行PBMC单采并分离NK细胞,用Claudin6靶向CAR转染NK细胞,根据需要扩增转染的NK细胞数量,测试Claudin6-CAR-NK细胞的质量和杀伤活性,然后移植回患者体内通过全身或局部输注,并根据需要密切随访以收集相关结果。
4.6 AMG 794
AMG 794是一款基于双特异性T细胞衔接蛋白(bispecific T cell engager,BITE®)技术平台开发的一款半衰期延长的双特异性抗体,可结合人和食蟹猴CLDN6和CD3。AMG 794可以重定向T细胞以杀死表达CLDN6的肿瘤细胞。目前处于临床I期招募患者阶段。
5、缔码全长CLDN6蛋白,助力CLDN6生物疗法开发
CLDN6与CLDN3、CLDN4和CLDN9等Claudins紧密相关,且存在遗传重叠,这对CLDN6靶向治疗的研发是一个巨大的挑战。但与CLDN6不同,这些紧密相关的蛋白在正常健康组织中表达,所以药物对CLDN6的高度选择性是CLDN6靶向治疗研发的关键突破口。基于此,高质量的抗原显得尤为重要,缔码生物全长CLDN6蛋白开发部分应用数据如下:
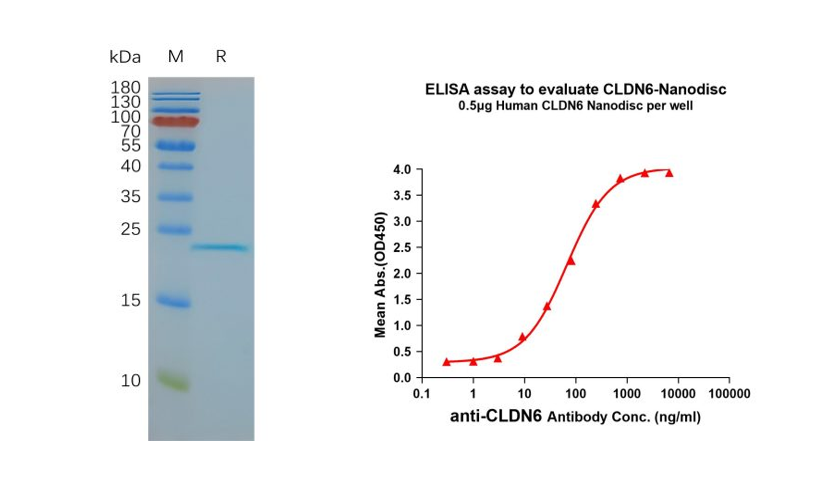
Figure 3. Validation data of purified full-length human CLDN6 Nanodisc (Cat. FLP100008). Human CLDN6-Nanodisc, Flag Tag on SDS-PAGE (left); CLDN6-Nanodisc (Cat. FLP100008) can bind to anti-CLDN6 mAb (Cat. BME100082) and the EC50 is 66.99ng/ml (right).
- CLDN6相关产品
参考文献:
[1] Furuse M ,Fujita K. Claudin 1 and -2;novel integral membrane proteins localizing at tight junctions with no sequence similarity to occlu-din [J].Cell Biol,1998,141(7) ;1539 ~ 1550.
[2] Günzel D., Fromm M. Claudins and other tight junction proteins. Compr. Physiol. 2012;2:1819–1852.
[3] Turksen K., Troy T.C. Claudin-6: A novel tight junction molecule is developmentally regulated in mouse embryonic epithelium. Dev. Dyn. Off. Publ. Am. Assoc. Anat. 2001;222:292–300.
[4] Harrison S.M., Dunwoodie S.L., Arkell R.M., Lehrach H., Beddington R.S. Isolation of novel tissue-specific genes from cDNA libraries representing the individual tissue constituents of the gastrulating mouse embryo. Development. 1995;121:2479–2489.
[5] Qu H, Jin Q, Quan C. CLDN6: From Traditional Barrier Function to Emerging Roles in Cancers. Int J Mol Sci. 2021 Dec 14;22(24):13416.
[6] Ben-David U, Nudel N, Benvenisty N. Immunologic and chemical targeting of the tight-junction protein Claudin-6 eliminates tumorigenic human pluripotent stem cells. Nat Commun. 2013;4:1992.
[7] Sas D, Hu M, Moe OW, Baum M. Effect of claudins 6 and 9 on paracellular permeability in MDCK II cells. Am J Physiol Regul Integr Comp Physiol. 2008 Nov;295(5):R1713-9.
[8] Kitajiri SI, Furuse M, Morita K, Saishin-Kiuchi Y, Kido H, Ito J, Tsukita S. Expression patterns of claudins, tight junction adhesion molecules, in the inner ear. Hear Res. 2004 Jan;187(1-2):25-34.
[9] Lu Y, Wang L, Li H, Li Y, Ruan Y, Lin D, Yang M, Jin X, Guo Y, Zhang X, Quan C. SMAD2 Inactivation Inhibits CLDN6 Methylation to Suppress Migration and Invasion of Breast Cancer Cells. Int J Mol Sci. 2017 Aug 30;18(9):1863.
[10] Ren Y, Wu Q, Liu Y, Xu X, Quan C. Gene silencing of claudin-6 enhances cell proliferation and migration accompanied with increased MMP‑2 activity via p38 MAPK signaling pathway in human breast epithelium cell line HBL‑100. Mol Med Rep. 2013 Nov;8(5):1505-10.
[11] Jia Y, Guo Y, Jin Q, Qu H, Qi D, Song P, Zhang X, Wang X, Xu W, Dong Y, et al. A SUMOylation-dependent HIF-1α/CLDN6 negative feedback mitigates hypoxia-induced breast cancer metastasis. J Exp Clin Cancer Res. 2020;39:42.
[12] Guo Y, Lin D, Zhang M, Zhang X, Li Y, Yang R, Lu Y, Jin X, Yang M, Wang M, et al. CLDN6-induced apoptosis via regulating ASK1-p38/JNK signaling in breast cancer MCF-7 cells. Int J Oncol. 2016;48:2435–2444.
[13] Song P, Li Y, Dong Y, Liang Y, Qu H, Qi D, Lu Y, Jin X, Guo Y, Jia Y, et al. Estrogen receptor β inhibits breast cancer cells migration and invasion through CLDN6-mediated autophagy. J Exp Clin Cancer Res. 2019;38:354.
[14] Adra N, Vaughn DJ, Einhorn LH, Hanna NH, Funt SA, Rosales M, Arozullah A, Feldman DR. A phase II study assessing the safety and efficacy of ASP1650 in male patients with relapsed refractory germ cell tumors. Invest New Drugs. 2022 Oct;40(5):1087-1094.
[15] Mackensen A, Haanen JBAG, Koenecke C, et al. CLDN6 CAR-T cell therapy of relapsed/refractory solid tumors ± a CLDN6-encoding mRNA vaccine: dose escalation data from the BNT211-01 phase 1 trial using an automated product. J Clin Oncol. 2023;41(suppl 16):2518.