还记得让美国科学家David Julius和Ardem Patapoutian获得2021年诺贝尔生理学或医学奖的温度和触觉受体-TRPV1吗?瞬时受体电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)因其可作为疼痛治疗靶点而受到业内人士的追捧。不过,随着TRPV1研究的深入,越来越多的文献证实TRPV1除了与疼痛相关,还与炎症、心血管疾病、咳嗽、精神疾病和糖尿病等疾病相关。其中,与疼痛相关的研究是最多的。这里,我们重点汇总了TRPV1在疼痛治疗方面的临床研究进展。在这之前,我们先来了解下TRPV1的生物学背景。
1、TRPV1结构
根据氨基酸序列的相似性,瞬时受体电位(TRP)家族可以分为7个亚家族,分别是TRPC (Canonical 1-7)、TRPV (Vanilloid 1–6)、TRPM (Melastatin 1–8)、TRPA (Ankyrin 1)、TRPN(NOMP)TRPP (Polycystic 1-3)和TRPML (Mucolopin 1-3) [1]。TRPV1就属于其中的香草酸亚家族,该亚家族还包括TRPV2、TRPV3、TRPV4、TRPV5和TRPV6。与其他亚家族相比,TRPV是目前研究最深入的TRP亚家族。TRPV1是1997年从大鼠背根神经节(DRG)神经元中克隆出的第一个哺乳动物TRP通道蛋白[2]。
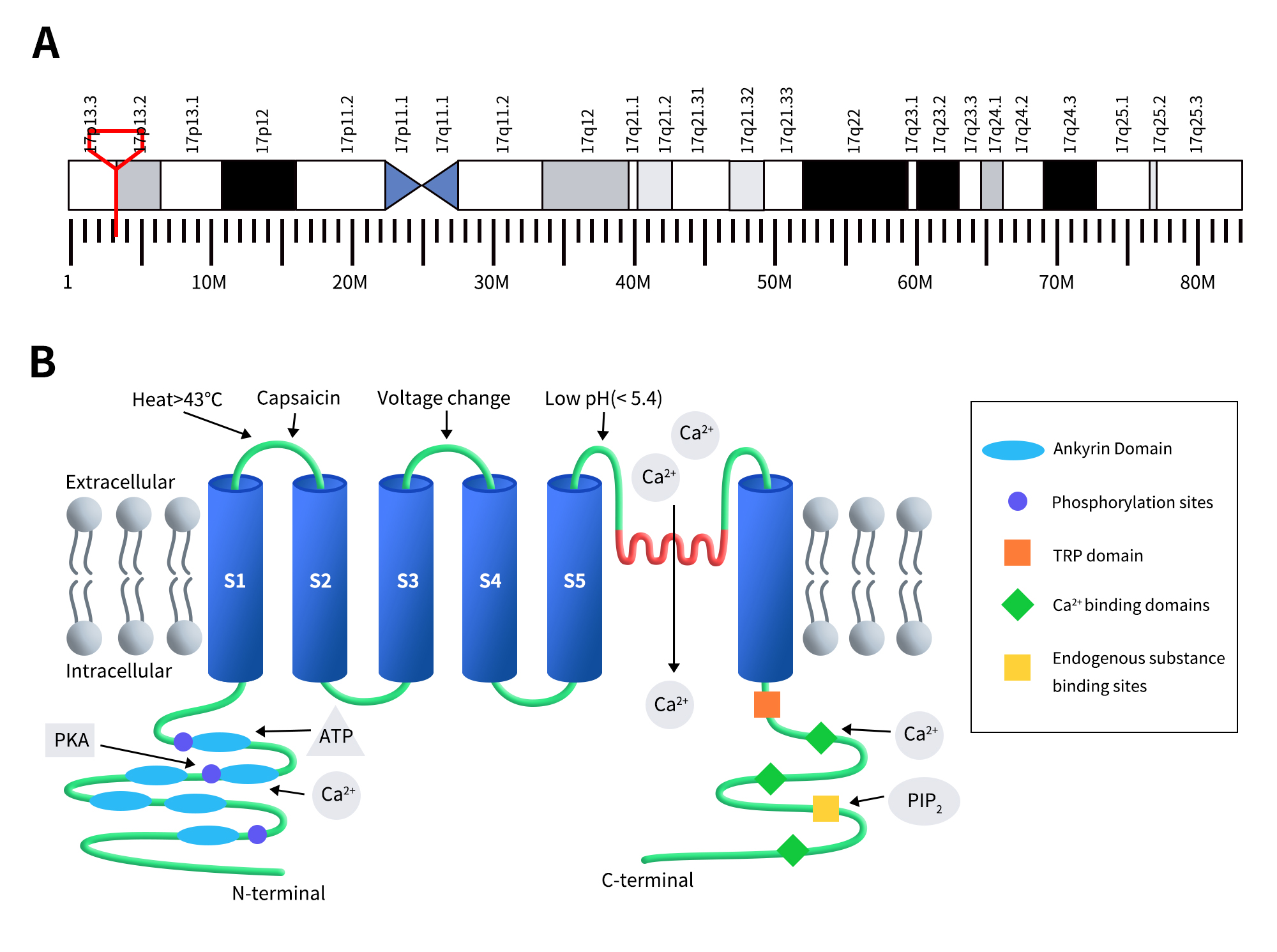
TRPV1也被称为辣椒素受体、瞬时受体电位阳离子通道V亚家族成员1(transient receptor potential cation channel subfamily V member 1)、香草酸受体1(vanilloid receptor 1,VR1)、以及Osm-9样TRP通道1(Osm-9-like TRP channel 1,OTRPC1)。人源TRPV1定位于染色体17p13.2,含有19个外显子,编码产生838个氨基酸,分子量为95kDa。2008年,Moiseenkova-Bell等人首次解析了TRPV1通道蛋白的结构 [3]。TRPV1蛋白是一种同源四聚体,围绕中心离子通路呈现四重对称性,每个亚基有六次跨膜区(S1-S6),在第5和第6个跨膜螺旋(分别为S5和S6)之间有一个可折返孔环(PL)(疏水柄),其N末端和C末端均位于细胞膜内侧,参与受体功能调控。N末端含有多个磷酸化位点和6个锚蛋白重复序列结构域(注:关于锚蛋白重复序列结构域数量,也有文献报道是4个[4]),可结合钙调蛋白和ATP,调节TRPV1的敏感性和功能 [5]。N端的锚蛋白重复序列由大约33个残基的重复基序组成,包含24个此类重复序列的拷贝,并通过77个氨基酸片段与S1相连[6]。C末端带有TRP结构域、多个钙调蛋白结合结构域和内源性物质结合位点,例如磷脂酰肌醇-4,5-二磷酸 (PIP 2) [7][8]。
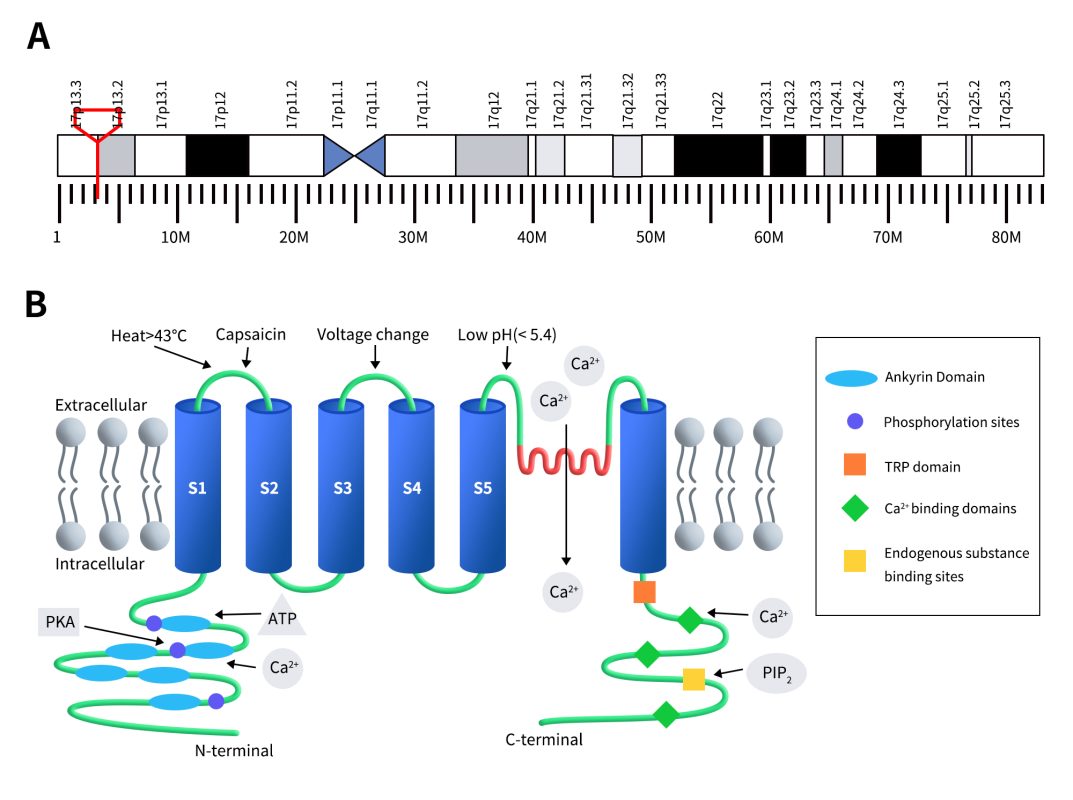
Figure 1. The gene location (A) and protein structure of TRPV1 (B) [5]
2、TRPV1分布与功能
TRPV1主要在DRG、三叉神经节(TG)和脊髓中高表达 [10]。目前,在中枢神经系统(CNS)的纹状体、杏仁核、丘脑、小胶质细胞、星形胶质细胞等区域以及毛囊、肥大细胞、平滑肌、角质形成细胞、肝脏、舌、口腔、膀胱、肾脏、肺、脾脏和耳蜗等非神经元组织中也有发现。在内嗅皮质、嗅球、海马、中脑导水管周围灰质(PAG)等区域也发现TRPV1有低水平表达 [11]。此外,TRPV1通道广泛存在于多种外周组织/系统中,包括脉管、胃肠道、膀胱和免疫系统 [12]。
Figure 2. The distribution of TRPV1 expression [9]
在正常的生理条件下,TRPV1在热感觉、口腔感觉、蛋白酶体活性、自噬调节、能量稳态、肌肉生理、胃肠道运动、炎症介质释放以及免疫系统和感觉神经系统之间的串扰中起着关键作用。
3、TRPV1在疼痛中的作用机制
由于TRPV1通道与多种生理过程有关,TRPV1功能或表达的改变与多种疾病有关,包括体温失调、疼痛、炎症、癌症、神经系统疾病、听觉系统疾病、眼部系统疾病、嗅觉/味觉缺失、感染、生殖系统疾病、呼吸系统疾病、肥胖、心血管系统疾病、糖尿病、皮肤系统疾病、泌尿系统疾病、肌肉系统疾病及骨骼系统疾病等 [13]。其中,关于TRPV1在疼痛和炎症中的研究居多。
如下图所示,在疼痛和炎症中,TRPV1与许多调节通道活性的炎症过程相关细胞内级联信号偶联。多种G蛋白偶联受体(GPCR)被促炎剂(比如:组胺和前列腺素)激活。Gs蛋白偶联受体激活后会导致腺苷酸环化酶(AC)活化,进而生成cAMP并激活和蛋白激酶A (PKA)。活化后的PKA会直接通过磷酸化TRPV1来调节其活性。Gq蛋白偶联受体激活后会导致磷脂酶-C (PLC)活化,从而将质膜相关PIP2降解为 1,2-二酰甘油(DAG)和(1,4,5)-肌醇三磷酸(IP3)。IP3的增加会引发Ca2+从细胞内(例如内质网(ER))释放。Ca2+和DAG均可激活蛋白激酶C (PKC),后者也会磷酸化TRPV1并调节其功能。根据受体的状态,PIP2会对TRPV1通道进行正向和负向调节。神经生长因子 (NGF) 等细胞外信号激活TRK受体也会导致PLC激活。激活TRPV1或电压依赖性钙通道(VDCC)通道,或通过促炎调节因子诱发的细胞内钙库释放钙会引起细胞内Ca2+升高,这也会调节TRPV1通道功能:Ca2+与TRPV1相关的钙调蛋白结合并促进通道脱敏。钙-钙调蛋白依赖性激酶 II (CaMKII) 直接磷酸化TRPV1通道。机械刺激会导致整合素依赖性src蛋白酪氨酸激酶(srcPTK)激活并直接作用于RPV1通道。此外,由于电压依赖性钙或钠 (VDSC) 通道激活而导致的细胞去极化直接门控该通道。
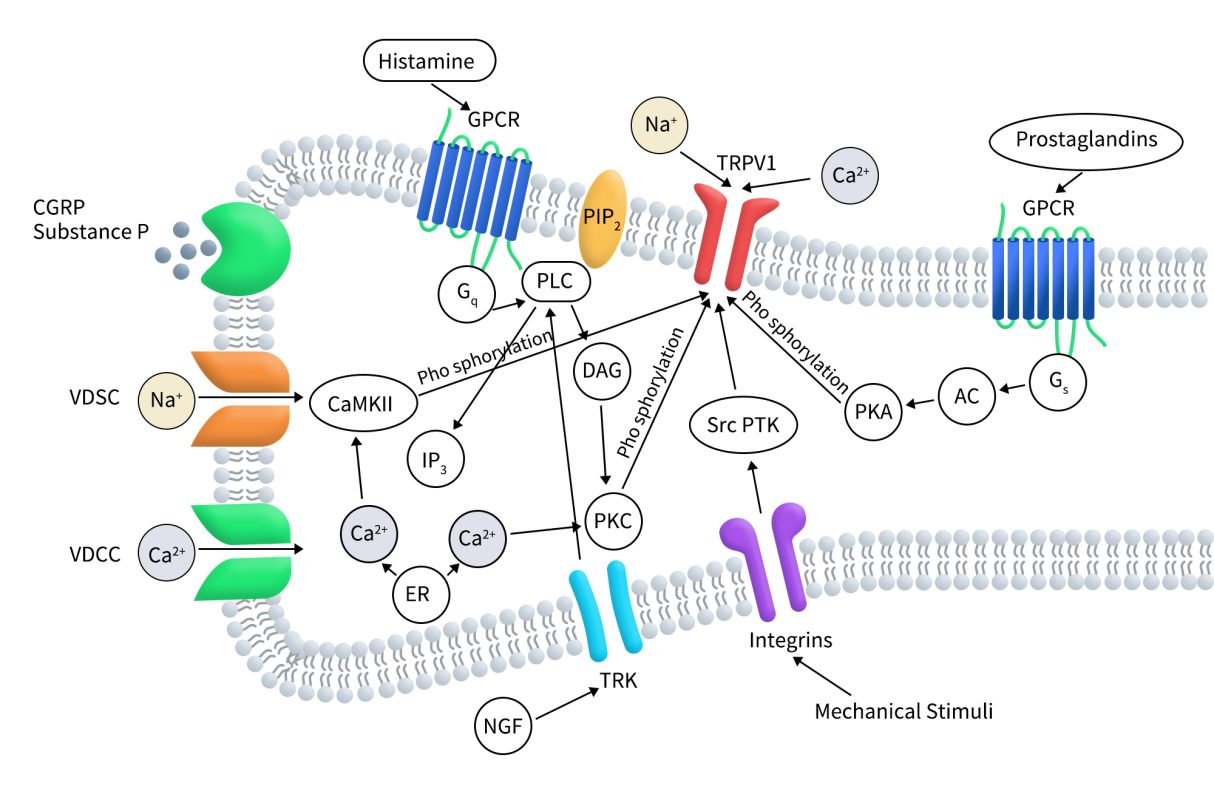
Figure 3. TRPV1 regulation by intracellular signaling pathways [14]
4、靶向TRPV1药物临床研究进展
不完全统计,目前全球靶向TRPV1药物共计106款。其中,处于临床前阶段的有31款,已终止及无进展的共计49款,获批上市的有3款,处于临床阶段的有15款。涉及多种药物类型,包括小分子化药、合成多肽、siRNA等,其中以小分子化药数量占主导,有近89款。而且,目前已上市的三款均为小分子化药。这里重点汇总了处于临床阶段的靶向TRPV1药物。
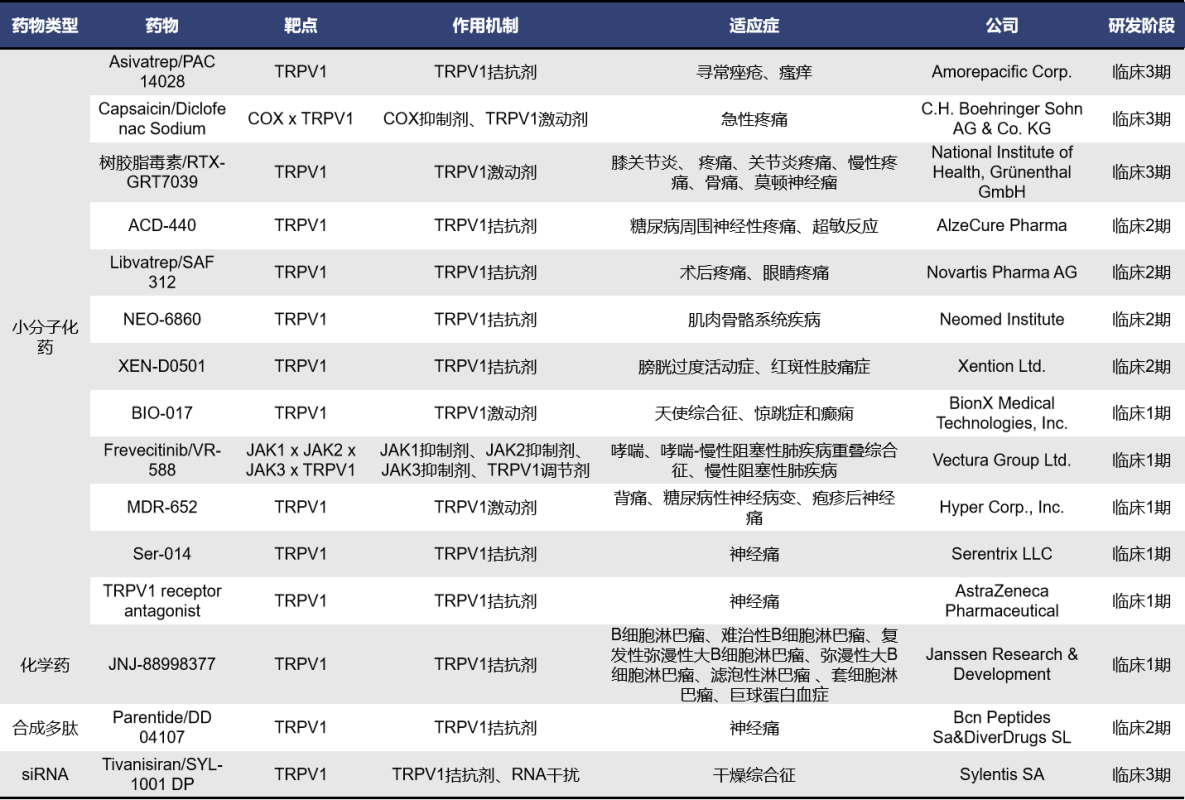
处于临床阶段的靶向TRPV1药物共计15款,其中小分子化药有12款,合成多肽有1款,siRNA有1款,化学药有一款。
Asivatrep,也称为PAC14028,是由Amorepacific Corp.开发的一款TRPV1拮抗剂,通过抑制P物质等神经肽的释放、改善皮肤屏障等方式发挥抗瘙痒效应,可能在特应性皮炎(AD)的瘙痒和炎症诱导中起重要作用。一项多中心、随机、双盲Ⅱb期临床研究(NCT02757729),纳入194例成人轻中度AD患者,分别外用0.1%、0.3%和1.0%的PAC-14028乳膏和安慰剂持续治疗8周。结果显示,整体评估(IGA)应答率分别为42.55%(0.1%)、38.30%(0.3%),57.45%(1.0%)及14.58%(安慰剂),有显著统计学差异。目前,一项评估PAC14028在青少年AD患者治疗中有效性和安全性(NCT02965118)的Ⅲ期临床试验正在进行。
RTX-GRT7039,也称为MTX-071,是一款TRPV1激动剂。树脂毒素(RTX)与TRPV1结合会延长通道的开放时间,从而大幅增加钙离子的流入,导致对TRPV1感觉神经元产生细胞毒性。目前,针对RTX-GRT7039,Grünenthal GmbH正在推进三项三期临床试验(NCT05248386、NCT05449132和NCT05377489),适应症都为骨关节炎,三项试验于2022年8月启动,当前都暂未开始招募。
ACD-440是由AlzeCure Pharma研发的一款TRPV1拮抗剂,用于周围神经病理性疼痛患者的局部治疗。ACD440于2021年完成了Ib期阳性研究。它显示出非常好的耐受性和安全性,而且这种物质作为凝胶涂抹在皮肤上,具有有效、持久的止痛效果。于2023年完成了一项临床II期试验(NCT05416931),这是一项双盲、安慰剂对照、随机交叉研究,旨在评估AlzeCure的主要镇痛候选药物ACD440的疗效、安全性和药代动力学,但结果暂未公布。
Parentide,也称为DD 04107或DD–04107,是由Bcn Peptides Sa和DiverDrugs SL开发的一款TRPV1拮抗剂,是一种合成多肽药物。目前该药物最高研发阶段为临床二期,用于治疗神经痛。
Tivanisiran,也称为SYL1001 DP,是由Sylentis开发的一款靶向TRPV1的siRNA药物,用于干眼症的治疗,以眼药水溶液的形式给药。目前Tivanisiran处在Ⅲ期试验阶段,评估治疗治疗干眼症以及干燥综合征引起的干眼症的安全性(NCT05310422;NCT04819269)。目前两项临床试验均已完成,但结果尚未公布。
5、缔码全长TRPV1活性蛋白助力药物研发
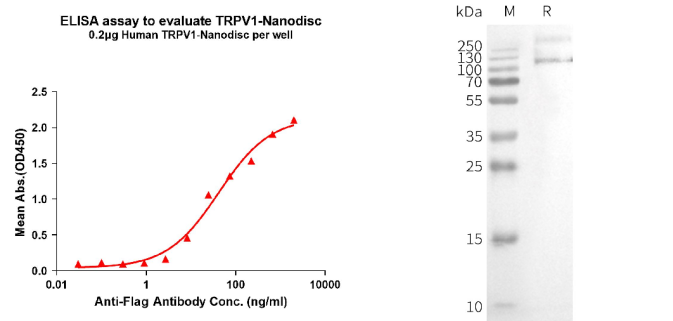
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码生物利用自主研发的Synthetic Nanodisc膜蛋白表达技术平台已开发出全长的人TRPV1蛋白。
与市面上大多数MSP(膜支持蛋白)Nanodisc不同,缔码生物研发的Synthetic Nanodisc是基于真核表达系统,能直接从完整的细胞中制作。在这个过程中,使用的合成高分子具有双重功能。首先,它溶解细胞膜,类似于洗涤剂,然后利用天然细胞磷脂在膜蛋白周围形成纳米盘结构。跨膜蛋白可整合到Nanodiscs中。目前,缔码生物已利用Nanodiscs全长膜蛋白平台开发了数百种膜蛋白,点击这个可查看所有膜蛋白。
Human TRPV1 full length protein-synthetic nanodisc (FLP100128)
此外,基于缔码生物单B细胞抗体发现、缔码功能膜蛋白开发、抗体工程改造与功能验证平台,缔码生物还可提供多种属蛋白抗体定制服务、抗体人源化亲和力成熟服务及先导分子发现服务。具体服务详情,欢迎致电垂询。
参考文献:
[1]Talavera K., Startek J. B., Alvarez-Collazo J., et al. Mammalian transient receptor potential TRPA1 channels: From structure to disease [J]. Physiol. Rev. 2020, 100, 725–803.
[2]Caterina MJ, Schumacher MA, Tominaga M, et al. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature. 1997 Oct 23;389(6653):816-24.
[3]Moiseenkova-Bell, V. Y., Stanciu, L. A., Serysheva, I. I., et al. Structure of TRPV1 channel revealed by electron cryomicroscopy. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(21), 7451–7455.
[4]Ramal-Sanchez, M., Bernabò, N., Valbonetti, L., et al. Role and Modulation of TRPV1 in Mammalian Spermatozoa: An Updated Review. International journal of molecular sciences, 2021, 22(9), 4306.
[5]Xiao T, Sun M, Kang J, Zhao C. Transient Receptor Potential Vanilloid1 (TRPV1) Channel Opens Sesame of T Cell Responses and T Cell-Mediated Inflammatory Diseases. Front Immunol. 2022 May 11;13:870952.
[6]Ma, L., Yang, F., Vu, S., & Zheng, J.. Exploring functional roles of TRPV1 intracellular domains with unstructured peptide-insertion screening. Scientific reports, 2016, 6, 33827.
[7]Garcia-Sanz N, Fernandez-Carvajal A, Morenilla-Palao C, et al. Identification of a Tetramerization Domain in the C Terminus of the Vanilloid Receptor. J Neurosci, 2004, 24(23):5307–14.
[8]Numazaki M TT, Takeuchi K, Murayama N, et al. Structural Determinant of TRPV1 Desensitization Interacts With Calmodulin. Proc Natl Acad Sci USA, 2003, 100(13):8002–6.
[9]Jaffal SM. Role of TRPV1 in Health and Disease. J Explor Res Pharmacol. 2023;8(4):348-361.
[10]Caterina MJ, Schumacher MA, Tominaga M, et al. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature 1997;389(6653):816-824.
[11]Cavanaugh DJ, Chesler AT, Jackson AC, et al. Trpv1 reporter mice reveal highly restricted brain distribution and functional expression in arteriolar smooth muscle cells. J Neurosci 2011;31(13):5067-5077.
[12]Li YR, Gupta P. Immune aspects of the bi-directional neuroimmune facilitator TRPV1. Mol Biol Rep 2019;46(1):1499-1510.
[13]Jaffal SM. Role of TRPV1 in Health and Disease. J Explor Res Pharmacol. 2023;8(4):348-361.
Jara-Oseguera A, Simon SA, Rosenbaum T. TRPV1: on the road to pain relief. Curr Mol Pharmacol. 2008 Nov;1(3):255-69.