瞬时受体电位锚蛋白1 (TRPA1)一种非选择性阳离子通道,可透过Ca2+,从而提高细胞内的Ca2+水平。TRPA1因其可对多种环境刺激物做出反应以及参与疼痛感知和炎症过程而特别受关注。不完全统计,目前,全球针对TRPA1靶点的在研药物共有22款(21款是小分子),其中进入临床的有6款。目前关于TRPA1药物的最新动态还是2023年礼来在第一季度季报中表明要放弃的一项止痛药TRPA1拮抗剂临床试验。今天我们就来聊聊目前TRPA1药物的临床研究进展,在此之前,我们先来了解下TRPA1的背景知识。
1、TRPA1的分布
瞬时受体电位(TRP)蛋白家族是一类位于细胞膜上的非选择性门控阳离子通道。根据其氨基酸序列的同源性,哺乳动物TRP通道可分为七个亚家族,包括TRPC、TRPV、TRPM、TRPP、TRPML、TRPA和TRPN [1]。瞬时受体电位锚蛋白1(TRPA1,又称ANKTM1)是TRPA亚家族的唯一成员,是一种Ca2+可渗透的非选择性阳离子通道,在不同类型的疼痛中起重要作用。TRPA1主要在三叉神经节、迷走神经节和背根神经节的初级感觉神经元亚群以及巨噬细胞、树突状细胞、T淋巴细胞、中性粒细胞和肥大细胞等非神经元细胞中大量表达 [2]。此外,也有研究表明TRPA1在肽能(富含神经肽CGRP和SP以及神经营养因子受体TrkA)和非肽能神经元(共表达嘌呤受体P2X3、Neurturin、Artemin、Mrg家族的G蛋白耦联受体以及GDNF受体家族中的GFRα1和GFRα2)均有表达 [3]。近些年,在一些非神经细胞(如内尔毛细胞、血管内皮细胞、牙髓成纤维细胞角质细胞、胰岛细胞等)上也发现了TRPA1的表达 [4]。
2、TRPA1的结构
TRPA1基因是在1999年从肺成纤维细胞中克隆出来的。人的TRPA1由1119个氨基酸组成,位于人类8号染色体q13,相对分子质量约127kDa。如图1所示,TRPA1跨膜蛋白有6个跨膜结构域(S1-S6)和1个孔道组成,其N末端和C末端均在胞内。S1和S2形成细胞外环结构,S5和S6跨膜结构域亲水区形成孔道。TRPA1蛋白的长NH2末端包含TRP超家族中最普遍的锚蛋白重复结构域(ARD),包括14-16个锚蛋白重复序列,每个锚蛋白重复序列由约33个氨基酸长度的α-helix-β-turn-α-helix基序组成[5],可能参与蛋白间相互作用,如与磷脂酶C (PLC)和钙(Ca2+)的结合。ARD通过pre-S1区与TM1连接,其中含有一些半胱氨酸残基(如Cys621、Cys641和Cys665),这些残基对于亲电激动剂激活TRPA1至关重要。N末端有1个EF手性结合域,能够增加细胞内钙离子。TRPA1可被辣根、肉桂醛、大麻、蒜素、芥末、质子等众多外源性有机小分子激活,但是对薄荷醇无反应。
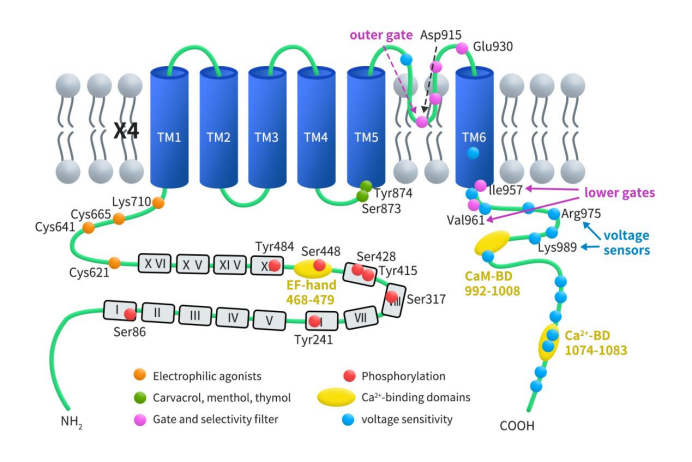
图1. TRPA1分子结构[6]
3、疼痛中TRPA1的作用机理
TRPA1通道由2021年诺贝尔生理学或医学奖得主Ardem Patapoutian教授发现,是一类非选择性配体门控阳离子通道,参与感知伤害性刺激和传导伤害性信号。TRPA1可以通过三种不同的方式被外源刺激激活:外源刺激通过G蛋白偶联受体(GPCR)和受体酪氨酸激酶(RTK)激活蛋白激酶C (PKC),调节TRPA1通道的活性;低分子量有机物和内源性酯类作为TRPA1的配体激活通道;温度变化和机械刺激直接作用于TRPA1通道,促进其打开和激活。TRPA1通道的激活或致敏,增加Ca2+内流,促进神经源性炎症反应和神经肽的释放,如P物质(SP)、神经激肽A(NKA)和降钙素二烯相关肽(CGRP)。
多项研究已证实TRPA1在介导痛觉性和神经性疼痛模型中对热、化学和机械刺激的长期超敏反应中扮演重要角色。McNamara CR等人首次证实了TRPA1参与炎性伤害感受。该研究表明在药理学拮抗作用或TRPA1通道基因缺失后,福尔马林在大鼠和小鼠爪子中诱导的伤害感受反应减少[8]。而且,在角叉菜胶和完全弗氏佐剂诱导的动物模型中,紧急抑制TRPA1可降低与持续炎症相关的冷和机械超敏反应 [9]。此外,TRPA1也被证实有助于外周和中枢神经性疼痛。在链脲佐菌素诱发的糖尿病神经病变啮齿动物模型中,TRPA1拮抗剂可减少机械性异常痛和超敏反应[10] [11]。
4、当前临床阶段TRPA1靶向药的研究进展
钌红、庆大霉素和阿米洛利和钆是文献中最早报道的TRPA1通道拮抗剂,这些非特异性通道阻滞剂已被更具选择性的TRPA1拮抗剂所取代。TRPA1作为离子通道类的镇痛靶点,没有阿片类药物的成瘾滥用风险。由于处于疼痛信号通路的上游,其靶向药物在阻断疼痛信号的同时,并不会影响机体的感觉模式。结合其在中枢神经和心脏中的表达丰度很低的特点,这样进一步降低了中枢神经和心脏副作用的风险,与其它镇痛靶点相比具有优越性。如前所述,当前处于临床阶段的靶向TRPA1药物共计6款,处于临床申请阶段的有1款,已获得临床审批的有一款。
| 药物 | 公司 | 适应症 | 研发阶段 |
| GRC-17536 | Glenmark Pharmaceuticals Ltd.Ichnos Sciences SA | 糖尿病周围神经病变 | 临床II期 |
| LY-3526318 | Eli Lilly & Co. | 糖尿病周围神经性疼痛、慢性疼痛 | 临床II期 |
| RG-6341 | Genentech, Inc.Roche Holding AG | 难治性慢性咳嗽、不明原因的慢性咳嗽、哮喘 | 临床II期 |
| HX-100 | Hydra Biosciences, Inc. | 哮喘 | 临床I期 |
| LD-2020 | 上海璃道医药科技有限公司 | 关节炎疼痛、癌症疼痛 | 临床I期 |
| A-967079 | Abbott Laboratories | 疼痛 | 早期临床1期 |
| LD-09163 | 上海璃道医药科技有限公司 | 炎症性肠病、溃疡性结肠炎、克罗恩病 | 临床申请批准 |
| LD-04185 | 上海璃道医药科技有限公司 | 纤维肌痛、神经痛 | 临床申请 |
- GRC 17536
GRC 17536(又称ISC 17536)也是一种可口服的TRPA1通道小分子拮抗剂,目前是由Glenmark Pharmaceuticals在推进临床开发。临床前研究已经证明GRC 17536在神经性和炎症性疼痛动物模型中的有效性,包括糖尿病外周神经性疼痛、骨关节炎疼痛、术后疼痛和化疗引起的疼痛,这些结果也验证了TRPA1阻断剂在治疗性疼痛管理中的潜在效用。2014年9月,Glenmark宣布已在IIa期疼痛性糖尿病外周神经病概念验证研究中取得了积极的成果,在亚组中至重度糖尿病性神经病性疼痛患者中具有统计学意义和临床相关反应。GCR 17536目前被FDA暂停临床使用,官方材料预计在2019年下半年恢复临床临床试验。需要注意的是,该条管线已从Glenmark Pharmaceuticals官网上移除。
- LY-3526318
如前所述,LY-3526318最初是由Hydra Biosciences原研,于2018年开始由礼来来推进临床试验。LY-3526318(又称为LY356318)是TRPA1小分子拮抗剂。2022年10月13日,礼来在美国和波多黎各完成骨关节炎、慢性腰痛和神经性疼痛的II期临床试验。2022年10月14日,礼来计划在日本健康志愿者中进行I期安全性和药代动力学试验。但2023年1月9日,礼来公司撤回了一项在日本招募健康志愿者(PO)之前的I期试验,官方给出的回复是因为商业决定。
- RG-6341
RG-6341,又称为GDC-6599,是罗氏开发的一款TRPA1抑制剂。临床前实验表明,GDC -6599在豚鼠肉桂醛诱发的咳嗽研究和AITC诱发的真皮血流模型中表现出强大的靶向作用。该分子是首个达到临床IIa期 ( NCT05660850)的口服TRPA1拮抗剂,用于治疗慢性咳嗽。
尽管多年来在整个制药行业进行了大量的TRPA1的研究,但只有GRC 17536和RG-6341进入了II期临床试验的终点。默沙东的CB 189625和Orion的ODM108均因药代不佳而终止,主因是溶解性较差和生物利用度较低。反观国内,目前只有璃道生物TRPA1拮抗剂LD-2020进展最快,当前已经在中国进入临床I期试验(CTR20240694),不过值得注意的是,璃道生物同时还有另外两款TRPA1抑制剂(LD-09163和LD-04185)分别处于临床申请批准和临床申请阶段,是目前国内拥有TRPA1抑制剂管线最多的公司。
5、缔码全长TRPA1蛋白,助力新药研发
如前所述,TRPA1是6次跨膜的通道蛋白,无论是抗体药还是小分子药,首先获得有活性的全长膜蛋白是至关重要的。缔码生物利用自主研发的Synthetic Nanodisc膜蛋白表达技术平台已开发出全长的人TRPA1蛋白。与市面上大多数MSP(膜支持蛋白)Nanodisc不同,缔码生物研发的Synthetic Nanodisc是基于真核表达系统,能直接从完整的细胞中制作。在这个过程中,使用的合成高分子具有双重功能。首先,它溶解细胞膜,类似于洗涤剂,然后利用天然细胞磷脂在膜蛋白周围形成纳米盘结构。跨膜蛋白可整合到Nanodiscs中。目前,缔码生物已利用Nanodiscs全长膜蛋白平台开发了数百种膜蛋白,点击这个可查看所有膜蛋白。
Human TRPA1 full length protein-synthetic nanodisc (FLP100033)
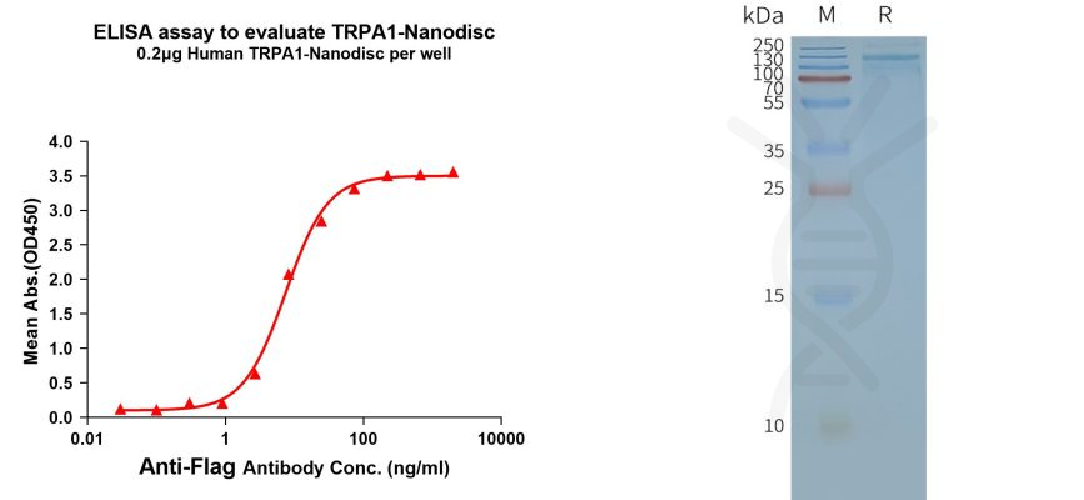
[Right] Human TRPA1-Nanodisc, Flag Tag on SDS-PAGE
参考文献:
[1]Talavera K., Startek J. B., Alvarez-Collazo J., Boonen B., Alpizar Y. A., Sanchez A., et al. (2020). Mammalian transient receptor potential TRPA1 channels: From structure to disease [J]. Physiol. Rev. 100, 725–803.
[2]Iannone LF, Nassini R, Patacchini R, Geppetti P, De Logu F. Neuronal and non-neuronal TRPA1 as therapeutic targets for pain and headache relief. Temperature (Austin) [J]. 2022 May 29;10(1):50-66.
[3]KRIMON S, ARALDI D, do PRADO F C, et al. P2X3 receptors induced inflammatory nociception modulated by TRPA1, 5-HT, and 5-HT1A receptors [J]. Pharmacol Biochem Behav, 2013, 112: 49-55.
[4]WILSON S R,GERHOLD K A, BIFOLCK-FISHER A, et al. TRPA1is required for histamine-independent, Mas-related G protein-coupled receptor-mediated itch [J]. Nat Neurosci, 2011, 14(5): 595-602
[5]Paulsen C.E., Armache J.P., Gao Y., Cheng Y., Julius D. Structure of the TRPA1 ion channel suggests regulatory mechanisms [J]. Nature. 2015;520:511–517.
[6]Moccia F, Montagna D. Transient Receptor Potential Ankyrin 1 (TRPA1) Channel as a Sensor of Oxidative Stress in Cancer Cells [J]. Cells. 2023 Apr 26;12(9):1261.
[7]BONET, FISCHER L, PARADA C A, et al.The role of transient receptor potential A 1 ( TRPA1) in the development and maintenance of carrageenan-induced hyperalgesia [J]. Neuropharmacology, 2013,65 ;206-212.
[8]McNamara CR, Mandel-Brehm J, Bautista DM, et al. TRPA1 mediates formalin-induced pain [J]. Proc Natl Acad Sci U S A. 2007;104(33):13525–13530.
[9]Bonet IJ, Fischer L, Parada CA, et al. The role of transient receptor potential A 1 (TRPA1) in the development and maintenance of carrageenan-induced hyperalgesia [J]. Neuropharmacology. 2013;65:206–212.
[10]Koivisto A, Hukkanen M, Saarnilehto M, et al. Inhibiting TRPA1 ion channel reduces loss of cutaneous nerve fiber function in diabetic animals: sustained activation of the TRPA1 channel contributes to the pathogenesis of peripheral diabetic neuropathy [J]. Pharmacol Res. 2012;65(1):149–158.
Wei H, Hamalainen MM, Saarnilehto M, et al. Attenuation of mechanical hypersensitivity by an antagonist of the TRPA1 ion channel in diabetic animals [J]. Anesthesiology. 2009;111(1):147–154.
