今年的2024 ASCO,惊喜不断。其中有一项是由虞先濬教授团队开展的MRG004A-001研究,该研究是MRG004A(一款靶向组织因子TF/CD142 ADC药物)在美国和中国正在进行的首次人体剂量递增和扩展研究。研究结果显示:在接受MRG004A 2.0mg/kg单药治疗12名可评估的胰腺癌患者中,客观缓解率(ORR)达33.3%(4/12),疾病控制率(DCR)高达83.3%(10/12)。这一结果的公布,让有最强癌王之称的胰腺癌被突破成为可能,也让组织因子TF这一靶点的关注度上涨。那组织因子TF究竟是什么?目前的相关靶向药物布局又有哪些?
1、组织因子TF的结构与分布
组织因子(TF),又称为凝血因子III(Coagulation factor III)或CD142,在人类中由位于1号染色体p21.3的F3基因编码,长度约为12.4kb。编码组织因子TF蛋白的序列由六个外显子组成。其中,外显子1编码前肽和翻译起始位点;外显子2-5编码胞外结构域;外显子6编码跨膜和胞质结构域[1]。
如下图所示,组织因子TF总共存在三种形式:flTF、asTF和替代外显子1A-组织因子(TF-A)。人类flTF是由295aa组成的单次跨膜糖蛋白,包含三个结构域:胞外结构域、跨膜结构域和胞质结构域。胞外结构域包含1-219aa,是由两个纤连蛋白III型结构域组成的N端部分,该结构域可与因子VIIa形成复合物,并以膜依赖的方式使蛋白酶对其天然底物因子IX、因子X和因子VII的活性提高几个数量级;跨膜结构域包含220-242aa,主要功能是将组织因子TF锚定在膜上;胞质结构域包含220-263aa,可进一步参与信号转导[1]。asTF无跨膜结构域,是可溶形式的组织因子,它是由组织因子mRNA 转录本选择性剪接而产生的,其中外显子5缺失,外显子4直接剪接至外显子6[2]。尽管asTF不是特别的促凝剂,但它参与非止血功能。与flTF相反,asTF可以在没有FVII协助的情况下结合整合素。TF-A变体是通过第一个内含子的可变剪接产生的 TF基因的新转录本。该过程导致包含一个来自第一个内含子内部序列的额外序列,称为外显子IA,称为 TF-A [3]。
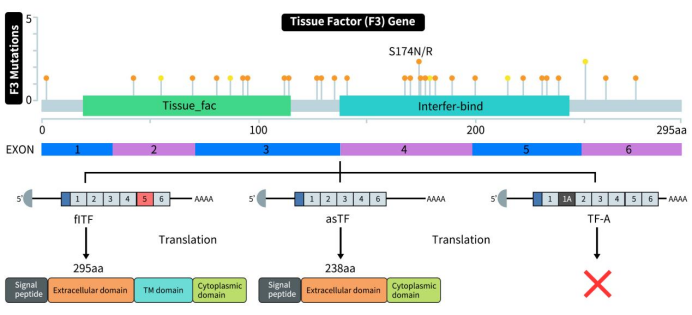
Figure 1. The structure of tissue factor (TF) [3]
组织因子TF由血管壁相关细胞组成性表达,包括血管平滑肌细胞、外膜成纤维细胞和周细胞。TF在胚胎发生中发挥作用,并在因子VII和VIIa之前在胚胎中表达。内皮细胞和巨噬细胞一般不表达TF,但当它们暴露在炎症、动脉粥样硬化、癌症等病理条件下时,细胞表面会表达TF。
2、组织因子TF的作用
组织因子 (TF) 通常通过在血管损伤后启动凝血级联来保护组织的血管完整性,是凝血级联反应的主要启动因子。在正常生理条件下,当TF暴露于血流中时,TF在适当磷脂膜上钙离子存在下与活化因子 VII (FVIIa) 形成复合物,并通过变构增强该蛋白酶的酶活性,催化因子 X (FX)活化为FXa。TF-FVIIa复合物产生FXa会触发凝血酶的产生,随后血小板被激活,并形成纤维蛋白凝块,从而恢复血管完整性。现在越来越多的证据表明,除了启动止血作用外,FVIIa与TF 的结合还直接裂解蛋白酶激活受体PAR2,导致TF胞质域磷酸化。这随后抑制了 PAR-2 介导的信号传导的负调控,从而促进血管生成[4]。
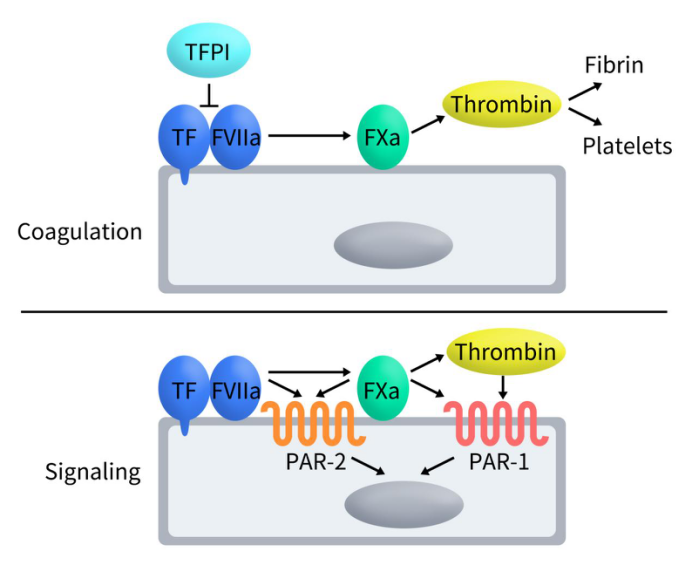
Figure 2. The role and mechanism of TF [4]
3、组织因子TF与癌症
如前所述,TF在多种癌细胞表面高表达,它在癌症的进展,癌细胞的侵袭与转移和血管生成中发挥作用。如下图所示,TF可通过激活JAK2-STAT5通路导致癌细胞不受控制地生长,继而阻止癌细胞凋亡;也可通过激活RTKs促进肿瘤细胞的生长;TF还可通过增加VEGF、抑制TSP导致肿瘤细胞的血管生成和转移增加;另外,TF可以激活rac1,rac1可进一步活化PKA从而调控MAPK,导致癌细胞的生长和转移;TF亦可激活PAR2,PAR2又通过多种方式导致癌细胞的血管生成、侵袭和转移增强。PAR2一方面通过增加VEGF、bEGF、 IL8和βTGF来促进血管生成、癌细胞的侵袭与转移;另一方面,PAR2可以稳定β-catenin并引起肿瘤细胞的侵袭。此外,PAR2还能通过激活MAPK和ERK1/2通路来增加 β-arrestin,从而磷酸化肌动蛋白丝切蛋白,导致侵袭细胞边缘的肌动蛋白丝聚合,从而增强肿瘤细胞的侵袭和转移。
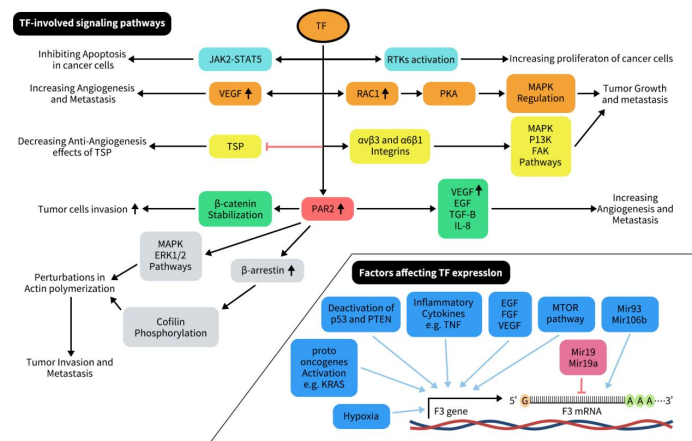
Figure 3. Overview of factors affecting F3 gene and TF-involved signaling pathways progressing cancer [3]
4、组织因子TF靶向疗法研究进展
由于TF在许多肿瘤中高表达,但在正常组织血管内壁的内皮细胞中不表达,因此靶向TF的药物可以被定向传递到肿瘤细胞而不靶向正常组织细胞,TF可作为ADC药物的理想靶点。全球范围内,目前针对TF的在研新药项目较少,且均为ADC药物。其中,由Genmab与Seagen联合开发的Tisotumab vedotin已于2021年9月获批上市。由上海信诺维生物开发的XNW-28012目前正处于临床I期;由乐普生物开发的MRG004A处于临床II期;由Iconic Therapeutics开发的XB002目前处于临床Ⅰ/II期。
- Tisotumab vedotin
Tisotumab vedotin,商品名为Tivdak,是由Seagen和GenMab联合开发的一款靶向组织因子TF的ADC药物,也是首个靶向TF的ADC药物。Tisotumab vedotin由三部分组成,包括抗组织因子的单克隆抗体Tisotumab、可剪切多肽连接子和细胞毒素单甲基奥瑞他汀E (MMAE),DAR=4。当Tisotumab vedotin与TF阳性肿瘤细胞相互作用时,它会被内化并发生溶酶体降解,从而在肿瘤细胞内释放 MMAE。MMAE是一种强效抗微管剂,可与微管蛋白结合并中断微管聚合,在G2/M期诱导细胞周期停滞,从而导致细胞凋亡;此外,MMAE还可以通过导致邻近细胞死亡(旁观者效应)在肿瘤微环境中被释放到细胞外[5]。
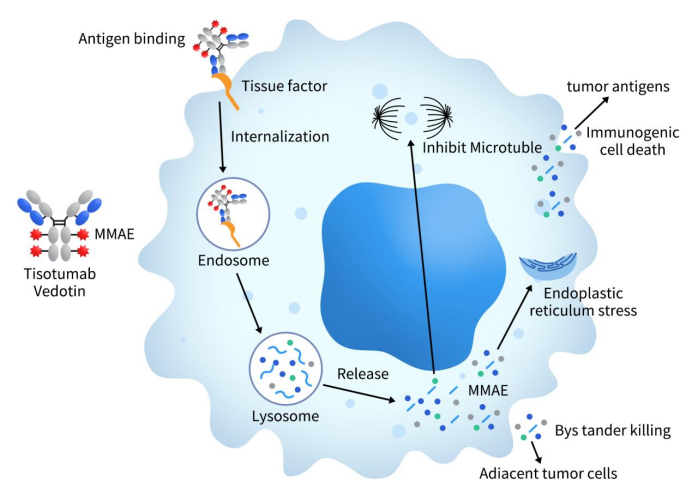
Figure 4. The mechanism of tisotumab vedotin [5]
该药于2021年9月20日获FDA加速批准上市,适应症为二线治疗复发性或转移性宫颈癌成年患者,获批依据是公布的关键试验 ENGOT-cx6/GOG-3023/innovaTV 204 结果。该结果表明,在接受铂类方案治疗后病情进展的复发性或转移性宫颈癌女性中,ORR为24%,且反应持续时间较长[5]。2022年9月,再鼎医药与Seagen达成合作协议,获得在中国内地、香港、澳门和台湾地区开发和商业化tisotumab vedotin的独家授权。
- XNW-28012
XNW-28012是由上海信诺维生物医药开发的一款靶向TF的ADC药物。目前关于这款ADC药物的描述并不多,有报道称XNW-28012小分子部分使用宜联生物TMALIN平台,Payload为YL0014。2023年7-8月,XNW28012先后获得CDE和FDA批准临床试验,主要用于治疗实体瘤。据其官方展示的非临床研究显示,XNW28012在TF高表达的多种实体瘤模型中展现出了良好抗肿瘤活性,且安全性特征良好,整体安全性可控。目前,官网显示的最高临床阶段为临床I期。
- MRG004A
MRG004A是由乐普生物开发的一种新型靶向组织因子(TF)的特异性ADC药物,该ADC药物采用Synaffix公司的定点偶联技术,DAR值为4。2023年12月,MRG004A用于治疗胰腺癌适应症获得FDA授予孤儿药资格认定。2024年3月,乐普生物公布MRG004A已获FDA授予快速通道资格,用于治疗胰腺癌。目前MRG004A正在美国及中国进行I/II期临床研究NCT04843709,在ASCO2024会议上公布了中期临床数据。
- XB002
XB002是Zymeworks与Exelixis合作开发靶向于组织因子TF的ADC药物,Payload为MMAE类似物。该药最初是由Iconic Therapeutics使用Zymeworks的ZymeLink™技术研发,2019年Exelixis与Iconic达成合作协议,获得了XB002的开发权益。XB002目前正在开展I期试验(NCT04925284)。
5、缔码TF相关产品助力TF生物药研发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供TF靶点全系列产品与服务。产品包括活性蛋白、参照抗体、流式验证单克隆抗体和稳赚细胞株;服务涵盖多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速TF生物疗法的开发,缔码还制备了TF靶点单B细胞种子库,最快28天可获得先导抗体分子。
- 蛋白&抗体&稳转细胞株产品
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100751 | Human CD142 Protein, hFc Tag |
| 流式验证抗体 | DMC100463 | Anti-CD142 antibody(DMC463); IgG1 Chimeric mAb |
| 参照抗体 | BME100124 | Anti-CD142(tisotumab biosimilar) mAb |
| 生物素标记抗体 | BME100124B | Biotinylated Anti-CD142(tisotumab biosimilar) mAb |
| DMC100463B | Biotinylated Anti-CD142 antibody(DMC463); IgG1 Chimeric mAb | |
| 稳转细胞株 | CEL100049 | Hu_CD142 K562 Cell Line |
- TF/CD142先导分子开发进展

参考文献:
[1]Butenas, Saulius. Tissue factor structure and function. Scientifica vol. 2012 (2012): 964862.
[2]Bogdanov VY, Balasubramanian V, Hathcock J, et al. Alternatively spliced human tissue factor: a circulating, soluble, thrombogenic protein. Nat Med. 2003 Apr;9(4):458-62.
[3]Ahmadi, S. E., Shabannezhad, A., Kahrizi, A., et al. Tissue factor (coagulation factor III): a potential double-edge molecule to be targeted and re-targeted toward cancer. Biomarker research, 2023, 11(1), 60.
[4]Mackman, N., & Taubman, M. Tissue factor: past, present, and future. Arteriosclerosis, thrombosis, and vascular biology, 2009, 29(12), 1986–1988.
[5]Agostinelli, V., Musacchio, L., Camarda, F., et al. Therapeutic Potential of Tisotumab Vedotin in the Treatment of Recurrent or Metastatic Cervical Cancer: A Short Report on the Emerging Data. Cancer management and research, 2023, 15, 1063–1072.
