癫痫相关同源物6(SEZ6)是在选定神经元谱系细胞的细胞表面上发现的跨膜蛋白。SEZ6在正常组织中表达有限,但在小细胞肺癌(SCLC)高表达,这一特性使其成为ADC药物的理想靶标。艾伯维在2024年ASCO会议上公布SEZ6 ADC药物ABBV-706在首次人体试验的单药剂量递增部分的早期数据。数据显示,在48名可评估有效性的患者中,整体确认的客观缓解率为43.8%。在小细胞肺癌组中,确认的客观缓解率为60.9%。其实这并不是艾伯维第一次布局SEZ6 ADC,早在2023 ASCO年会上,艾伯维就展示了其SEZ6 ADC药物ABBV-011的I期数据,ORR为25%,中位反应时间为4.2个月,mPFS为3.5个月。但同年8月,艾伯维在其管道网页的更新中删除了ABBV-011这款早期阶段的抗体药物偶联物,这表明该公司正在终止ABBV-011候选药物的开发。所以,ABBV-706准确来说应该是艾伯维开发的第二代SEZ6-ADC,那SEZ6究竟有何魔力让艾伯维一而再的对其进行布局呢?
1、SEZ6与SEZ6家族
人源癫痫相关同源物6(seizure related 6 homolog,SEZ6)是由位于17q11.2染色体的SEZ6基因编码,是SEZ6家族中的一员。SEZ6家族另外两个成员为癫痫相关6样蛋白(SEZ6L)和癫痫相关6样蛋白2 (SEZ6L2)。SEZ6L和SEZ6L2与SEZ6有超过40%的同一性和60%的相似性。SEZ6因其 mRNA选择性剪接可产生不同的SEZ6亚型:两种(Sez6 I型和II型)是具有单个跨膜结构域(I型跨膜)的细胞表面蛋白,而Sez6 III型是分泌型亚型(sSez6)。Sez6家族成员的结构域由5个结构域Sushi结构域和2-3个CUB结构域组成。Sushi结构域,也称为补体控制蛋白(CCP)结构域或短共识重复序列(SCR),含有60-70个氨基酸,其中四个不变的半胱氨酸形成二硫键。该结构域可参与许多识别过程,包括几种补体因子与C3b和C4b片段的结合。CUB结构域(补体亚成分C1r/C1s、Uegf、Bmp1)是一种约有110个残基的结构基序,几乎只存在于细胞外和质膜相关蛋白中,其中许多受发育调控。此外,SEZ6 C末端结构域预计含有NPxY结合基序,该基序通常参与蛋白质内吞作用,据报道,它对SEZ6L2的内化很重要[1][2]。
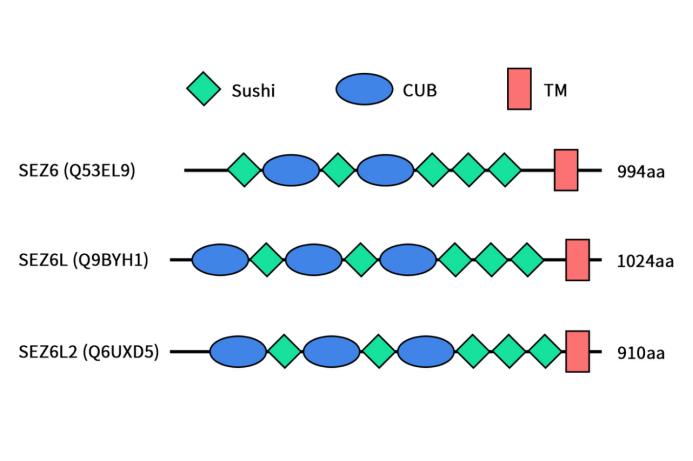
Figure 1. The structures of the SEZ6 family
2、SEZ6分布与功能
SEZ6、SEZ6L和SEZ6L2具有独特的空间和时间表达模式。其中,SEZ6主要在神经元中表达,在胚胎和出生后的新皮质中表达最高。在成年小鼠大脑中,SEZ6表达降低,但在中皮质层、嗅小管、扣带皮层和海马(主要在CA1中)中仍可检测到[3]。
尽管SEZ6基因敲除小鼠早在十多年前就已出现,但SEZ6的分子功能仍然在很大程度上未知。由于SZE6 mRNA在发育中的前脑中高度表达,SEZ6被认为在大脑皮层、海马和丘脑的发育和功能中起着关键作用。行为方面,SEZ6基因敲除小鼠表现出初级运动能力受损、长期记忆缺陷和焦虑水平下降[4]。此外,由于SEZ6的结构富含Sushi和CUB结构域,两者都参与蛋白质-蛋白质相互作用并包含在许多神经递质受体结合蛋白中,SEZ6和相关家族成员可能参与细胞间粘附或离子型神经递质受体的调节[5]。这两个结构域除了存在于神经递质受体结合蛋白中,也存在于补体途径的蛋白中,这表明SZE6及其家族成员可能具有与补体级联相关的活性。Wen Q Qiu等人的研究表明,Sez6家族成员通过经典和替代途径抑制C3b/iC3b 调理作用,其功效程度各不相同。在补体经典途径中,Sez6 是一种强抑制剂,Sez6L2是一种中度抑制剂,而Sez6L是一种弱抑制剂。在替代途径中,Sez6、Sez6L和Sez6L2的补体抑制活性均大于等于已知补体调节剂MCP的活性[6]。
3、SZE6临床药物研究进展
SEZ6参与神经树突形成,并调控神经信号传递,与神经内分泌肿瘤(NET)的进展密切相关;另外,由于SEZ6选择性高表达在神经内分泌肿瘤细胞上,但在大多数正常组织中表达极少,这种差异表达使其成为NET潜在的药物靶点。目前全球公开的SEZ6靶向药物的临床管线只有两条,ABBV-011与ABBV-706,均是出自艾伯维,其中ABBV-011已于2023年8月由艾伯维宣告终止。
ABBV-706是一种靶向SEZ6的ADC,与毒素拓扑异构酶1抑制剂TOP1i通过连接子Valine-alanine结合,DAR为6。ABBV-706可靶向表达SEZ6的肿瘤细胞,迅速内化,并递送杀死肿瘤细胞的Top1i有效载荷。ABBV-706在各种SCLC细胞系中表现出显着的抗增殖活性,同时在SCLC PDX 模型中肿瘤出现持续消退。目前正在开展I期临床试验,于2022年10月 31日开始,目标是招募350名参与者,并计划于2026年12月18日结束,招募工作仍在进行中。
这是一项I期首次人体试验,旨在评估ABBV-706作为单药或与布迪加利单抗(ABBV-181)、卡铂或顺铂联合治疗晚期实体瘤患者的安全性、药代动力学和疗效。该试验分为四部分:在第 1部分(剂量递增)中,ABBV-706 将以单药疗法以递增剂量静脉输注,直至确定SCLC、高级别 CNS 肿瘤和高级别 NEC患者的最大耐受剂量 (MTD)。在第2部分中,将从第1部分中选择多个剂量,并将SCLC患者随机分配到其中一个剂量,以确定推荐的2期剂量。在第3a部分中,SCLC或NEC患者将每3周静脉接受ABBV-706与budigalimab 联合治疗。在第3b部分中,SCLC或NEC患者将静脉接受ABBV-706与卡铂或顺铂联合治疗。在第4a部分中,患有中枢神经系统肿瘤的参与者将以第1部分确定的剂量静脉注射ABBV-706。在第4b部分中,患有NEC的参与者将以第1部分选择的剂量静脉注射ABBV-706。该研究的预计持续时间长达3年。
在2024 ASCO会议上,艾伯维分别公布了ABBV-706在晚期实体瘤患者(pts)中开展的首次人体研究的早期数据。摘要和演讲中的统计数据分别截止至2023年11月15日和2024年3月20日。截止至2023年11月15日,在33名可评估疗效的患者中,确认的客观缓解率(ORR)总体为 21%(7 名部分缓解),其中SCLC为 40%(6/15),NEN为6%(1/18)。主要不良事件包括贫血(51%)、疲劳(41%)、中性粒细胞减少 (31%)和白细胞减少(31%),未观察到肺炎/间质性肺病。最大耐受剂量为3 mg/kg IV Q3W。未经确认的总体缓解率为 45%,其中SCLC 患者为73%,NEN患者为22%。临床获益率为 91%。数据截止到2024年3月20日,在48名可评估疗效的患者中,确认的ORR为44%(21/48),其中SCLC为60.9%(14/23),NEN为28%(7/25)。主要不良事件包括中性粒细胞减少症 (42%)、贫血 (42%) 和白细胞减少症 (28%)。
4、缔码SEZ6相关产品助力SEZ6生物药开发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供SEZ6靶点全系列产品与服务。产品包括活性蛋白、流式验证单克隆抗体和稳转细胞株产品;服务涵盖多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速SEZ6生物疗法的开发,缔码还制备了SEZ6靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们目前已筛选出有17个SEZ6先导分子,客户第二天可以拿到分子进行功能评估验证;针对部分分子,我们也正在进行ADC内吞活性及杀伤验证,具体数据欢迎垂询。
- 现货蛋白&抗体&细胞株
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME101194 | Human SEZ6 Protein, His Tag |
| PME-M100083 | Mouse SEZ6 Protein, His Tag | |
| 流式验证抗体 | DMC101096 | Anti-SEZ6 antibody(31A10), IgG1 Chimeric mAb |
| 生物素标记抗体 | DMC101096B | Biotinylated Anti-SEZ6 antibody(31A10), IgG1 Chimeric mAb |
| 稳转细胞株 | CEL100037 | Hu_SEZ6 K562 Cell Line |
- SEZ6先导分子开发进展

参考文献:
[1]Bonifacino JS, Traub LM (2003) Signals for sorting of transmembrane proteins to endosomes and lysosomes. Annual review of biochemistry 72:395-447.
[2]Boonen M, Staudt C, Gilis F, et al. (2016) Cathepsin D and its newly identified transport receptor SEZ6L2 can modulate neurite outgrowth. Journal of cell science 129 (3):557-568.
[3]https://edoc.ub.uni-muenchen.de/25170/7/Pigoni_Martina.pdf.
[4]Gunnersen JM, Kim MH, Fuller SJ, et al. (2007) Sez-6 proteins affect dendritic arborization patterns and excitability of cortical pyramidal neurons. Neuron 56 (4):621-639.
[5]Lin HH, Stacey M, Saxby C, et al. (2001) Molecular analysis of the epidermal growth factor-like short consensus repeat domain-mediated protein-protein interactions: dissection of the CD97-CD55 complex. The Journal of biological chemistry 276 (26):24160-24169.
[6]Qiu WQ, Luo S, Ma SA, et al. The Sez6 Family Inhibits Complement by Facilitating Factor I Cleavage of C3b and Accelerating the Decay of C3 Convertases. Front Immunol. 2021 Apr 15;12:607641.
