寻找在肿瘤细胞上表达,而在正常细胞上不表达或低表达的靶点对肿瘤免疫而言至关重要。ROR1是一个非常有潜力的药物靶点,它在多种实体瘤和血液恶性肿瘤中都具有差异化的高度表达,而在成人健康组织中并不表达。这意味着ROR1有望成为一个具有广谱抗癌潜力的新药靶点。
1、ROR1结构与表达分布
ROR1(receptor tyrosine kinase-like orphan receptor 1)是一种I型跨膜蛋白,属于受体酪氨酸激酶样孤儿受体(ROR)家族。该家族的命名是因为其配体多年未被识别。现在已知ROR家族成员是Wnt家族信号分子Wnt5a/b和Wnt16的受体,Wnt5a为主要配体。
如下图所示,ROR1是单次跨膜受体,主要包括三部分:胞外区、跨膜区和胞内区。胞外区(ECD)可进一步分为三个结构域:免疫球蛋白样结构域(Ig-Like)、卷曲结构域(FZD)及环状结构域(KD)。FZD可与配体Wnt5a结合来调节非经典Wnt信号。KD可介导ROR1与其他受体如ROR2的相互作用。胞内结构域(ICD)包含一个酪氨酸激酶样结构域、两个富含丝氨酸/苏氨酸结构域和一个富含脯氨酸结构域。
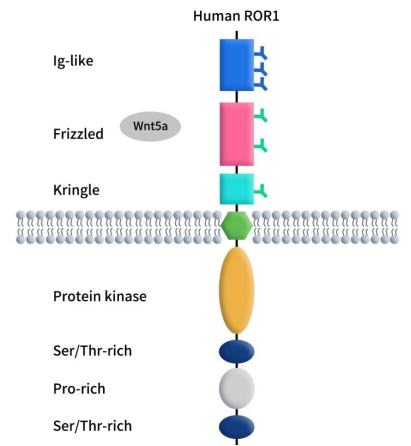
Figure 1 The structure of ROR1 [1]
ROR1在早期胚胎发育过程中高表达,可参与细胞分裂、增殖、迁移活动的调节,同时也能参与神经、骨骼和血管等器官的生成。随着胎儿发育的进程,ROR1的表达逐渐下降。在儿童和成人阶段,ROR1几乎在所有正常组织中的表达都很低或不表达。相反,ROR1在多种癌症中表达,包括血液学癌症,如慢性淋巴细胞白血病(CLL)、套细胞淋巴瘤(MCL)和实体瘤(卵巢癌、乳腺癌、前列腺癌、肺癌、黑色素瘤和结肠直肠癌等)。ROR1的表达特性使得该蛋白成为癌症治疗的理想药物靶点。
2、ROR1信号与肿瘤发生
研究表明,肿瘤细胞中ROR1的高表达有助于提高肿瘤细胞的存活率,促进肿瘤细胞的增殖、迁移和趋化。表达ROR1的血液肿瘤和实体肿瘤具有很高的自我更新潜力,表现出更高的生存率和迁移率,并与不良预后相关。
Wnt5a-ROR1通过非典型Wnt通路参与并上调YAP/TAZ转录和/或多梳复合蛋白BMI-1表达,在肿瘤发生和耐药中发挥重要作用。Wnt5a结合ROR1后诱导细胞内信号传导,活化AKT,进而磷酸化BMI-1,促进基因组不稳定性、癌细胞增殖和耐药。Wnt5a与ROR1/FZD复合物结合后,通过Gα12/13结合激活RhoA,抑制Lats1/2活性,从而导致YAP/TAZ去磷酸化和核转位。YAP/TAZ与TEADs结合可以诱导干细胞和肿瘤发生相关基因的转录。YAP/TAZ转录的增加,反过来上调ROR1的表达。
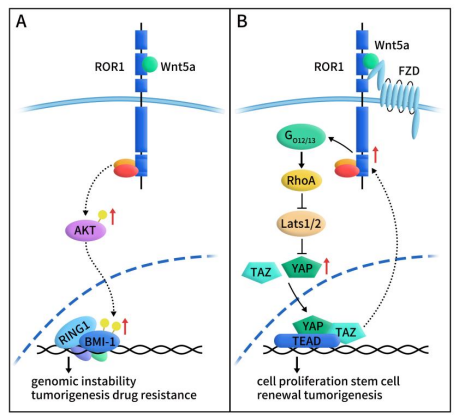
Figure 2 ROR1 signaling pathway and tumor [2]
3、ROR1与肿瘤免疫
目前开发的靶向ROR1的基于抗体的免疫疗法包括ROR1单克隆抗体、抗体药物偶联物(ADC)、双特异性抗体(BiTE)和嵌合抗原受体(CAR) T细胞。当然,靶向ROR1的除了免疫疗法,也还有小分子抑制剂,这里我们重点了解下靶向ROR1免疫疗法在临床上研究进展。
| 药物类型 | 英文名称 | 研发代码 | 研发阶段 | 公司 |
| ROR1 ADC | Zilovertamab vedotin | MK-2140; VLS-101 | Phase III | 默沙东 |
| LCB-71 | CS-5001; LCB-71; ABL-202 | Phase I | 基石药业 | |
| NBE-002 | BI-3702025; NBE-002 | Phase II | NBE-Therapeutics | |
| CAR-T | LYL-797 | LYL-797 | Phase I | Lyell Immunopharma Inc |
| PRGN-3007 | PRGN-3007 | Phase I | Precigen Inc | |
| ONCT-808 | ONCT-808 | Phase II | Oncternal Therapeutics Inc | |
| 双特异抗体 | NVG-111 | NVG-111 | Phase II | NovalGen Ltd |
| EMB-07 | EMB-07 | Phase I | EpimAb | |
| 四特异性抗体 | GNC-035 | GNC-035 | Phase I | Systimmune |
| 单克隆抗体 | Zilovertamab | UC-961 | Phase III | Oncternal Therapeutics Inc |
3.1 抗体药物偶联物(ADC)
ADC是一种靶向治疗药物,通过化学连接物将细胞毒性小分子偶联到单克隆抗体上。抗体药物偶联物可选择性地向抗原阳性的癌细胞输送有毒物质。
- Zilovertamab vedotin (VLS-101)
Zilovertamab vedotin原研公司为VelosBio,该公司已于2020年11月5日由默克以27.5亿美元收购。Zilovertamab vedotin是一款靶向ROR1的ADC药物,由靶向ROR1的单克隆抗体通过蛋白水解可裂解接头与单甲基auristatin E (MMAE)偶联。MMAE是一种通过阻断微管蛋白聚合抑制细胞分裂的药物,更多关于MMAE内容>>
Zilovertamab vedotin目前最高研发状态是phase III,DAR均值为4,用于治疗血液系统恶性肿瘤和实体瘤患者。在2023年ASH会议上,默沙东披露了Zilovertamab vedotin治疗复发或难治性弥漫性大B细胞淋巴瘤 (DLBCL)的2期Waveline-004研究的最新结果。在这次更新的Waveline-004结果中,zilovertamab vedotin在R/R DLBCL患者中依然表现出具有临床意义的抗肿瘤活性。这些患者主要是一些:在自体干细胞移植 (ASCT) 或嵌合抗原受体 (CAR-T) 细胞治疗后病情进展或不符合ASCT和/或CAR T细胞治疗的条件的 R/R DLBCL 患者,治疗选择有限。zilovertamab vedotin 的安全性是可控的,并且与已知的含MMAE药物的安全性一致。
- LCB71 (CS5001)
LCB71最初是由韩国的两家生物制药公司LegoChem Biosciences和ABL Bio开发,2020年10月29日基石药业以1000万美元的首付款+3.535亿美元里程碑金额引进LCB71。LCB71 是一款由靶向ROR1的人源单克隆抗体构成的ADC。目前最高研发阶段为Phase I,针对的适应症包括实体瘤和血液肿瘤。
该ADC药物具有独特的设计,通过定向偶联技术,LCB71结合了特有的β-葡萄糖苷酸连接子和吡咯并苯二氮卓类(PBD)前毒素二聚体。连接子和前毒素均能被溶酶体β-葡萄糖醛酸酶切割,而β-葡萄糖醛酸酶在许多癌细胞中呈过度表达。这使得LCB71只有在到达肿瘤后,其连接子被切割释放PBD前毒素,继而PBD前毒素在肿瘤细胞内被激活,从而杀死肿瘤细胞。这种连接子加前毒素的“双控”机制有效地解决了与传统PBD载荷有关的典型毒性问题,拥有更好的安全性。
LCB71的多地区I期临床试验已在美国和澳大利亚通过剂量递增推进,并显示出良好的安全性和耐受性。2023年4月24日,基石药业宣布LCB71的多区域I期临床试验在中国完成首例患者入组。基石药业首席执行官杨杰博士表示:这标志着我们 Pipeline 2.0 战略的另一个里程碑。随着中国研究中心的加入,这一重要项目的步伐将进一步加快。
- NBE-002
NBE-002最初由NBE-Therapeutics开发,2020年12月10日勃林格殷格翰宣布以约15亿美元的价格收购NBE-Therapeutics,从而获得NBE-002。NBE-002是一种ADC,由一种新型抗人 ROR1 单克隆抗体抗体XBR1-402与蒽环类药物PNU-159682的衍生物组成。HuXBR1-402是从兔抗体库中通过噬菌体展示筛选出的兔/人嵌合单抗。
NBE-002在乳腺癌、肺腺癌、卵巢癌和肉瘤的患者源性异种移植模型中显示出显著的抗肿瘤活性。目前该药物正在美国针对晚期实体瘤患者首次开展人体 1/2 期研究,旨在评估 NBE-002在晚期实体瘤患者中的进一步临床开发推荐剂量、安全性、耐受性、抗肿瘤活性、免疫原性、药代动力学和药效学。
3.2 ROR1的CAR-T细胞疗法
构建靶向ROR1的CAR-T细胞疗法也可以起到针对性杀伤ROR1阳性癌细胞的作用。
- LYL-797
LYL-797是由Lyell Immunopharma开发的一种靶向ROR1的CAR-T 细胞疗法,它结合了遗传和表观遗传重编程技术Gen-R和Epi-R,以克服实体瘤中CAR-T细胞疗法的障碍。ROR1 特异性CAR包含源自R12兔单克隆抗体的单链可变片段(scFv),可高度特异性地识别并结合人ROR1。
Gen-R是一种离体基因重编程技术,可将CAR-T细胞改造为过度表达c-Jun。激活蛋白1 (AP-1) 的失调与CAR-T细胞耗竭有关,研究表明c-Jun的过度表达可以使CAR-T细胞不易耗竭,从而增强血液肿瘤和实体瘤临床前模型中的抗肿瘤功效和持久性。Epi-R是一种专有的优化制造工艺,可维持T细胞产品的干细胞表型和功能。在临床前研究中,与传统的ROR1 CAR-T细胞相比,用Gen-R和Epi-R重新编程的LYL797细胞在ROR1+肿瘤细胞存在的情况下功能活性得到提高 [3]。
LYL797-101正处于一项Phase I临床试验(NCT05274451),该试验旨在评估LYL797在ROR1+ 三阴乳腺癌(TNBC)和非小细胞肺癌(NSCLC)中的安全性、药代动力学(PK)和抗肿瘤活性,目前正处于招募状态。
- PRGN-3007
PRGN-3007是Precigen公司基于非病毒UltraCAR-T™治疗平台产生的多基因、自体CAR-T细胞疗法。PRGN-3007使用单个多基因转座子质粒进行工程设计,利用睡美人平台(SB系统)共表达靶向ROR1嵌合抗原受体、膜结合白介素-15(mbIL15)、控制开关以及内在阻断 PD-1 的新机制基因表达。目前,PRGN-3007正在美国针对ROR1+血液肿瘤和实体肿瘤开展1/1b阶段的临床试验以测试该药物的耐受性。
- ONCT-808
ONCT-808是一种由Oncternal Therapeutics公司开发的一种靶向ROR1的自体CAR-T细胞疗法,目前正在进行1/2期临床试验(NCT05588440),用于治疗复发或难治性侵袭性B细胞淋巴瘤患者,包括先前CD19 CAR T治疗失败的患者。该临床试验旨在评估 ONCT-808 在侵袭性 BCL患者中的安全性和有效性。该研究包括两个不同的阶段:第一阶段剂量递增,第二阶段剂量扩大,目前正处于招募状态。
3.3 双特异性抗体
- NVG-111
NVG-111是一种NovalGen原研的人源化ROR1和CD3 BiTE,是由ROR1和CD3的scFv串联而成的双特异性抗体。NVG-111靶向ROR1阳性的恶性细胞并利用T细胞固有的细胞毒作用,从而在体内和体外诱导肿瘤细胞死亡。临床前研究表明,NVG-111在CLL和实体肿瘤中具有良好的T细胞介导的细胞毒性。NovalGen在2023 ASH上公布了NVG-111的Phase I首次人体剂量递增研究结果。公布的数据为TCE选择性靶向ROR1提供了临床概念验证,即使在已知T细胞功能缺陷的CLL患者中,也能获得抗肿瘤活性的客观证据,并具有反应持久性。安全性与作用机制一致。
- EMB-07
EMB-07是由EpimAb 开发的一种T细胞重定向双特异性抗体,靶向ROR1和CD3。 EMB-07是基于EpimAb专有的 FIT-Ig(Fabs-In-Tandem 免疫球蛋白)技术进行设计的双特异性抗体。EMB-07与肿瘤细胞表面的TAA结合后,可以招募并激活表达CD3的T淋巴细胞,从而促进T淋巴细胞的细胞毒作用。在临床前实验中,EMB-07显示出极具潜力的疗效和安全性。目前处于治疗淋巴瘤的I期阶段。
3.4 四特异性抗体
GNC-035是由Systimmune开发的八价四特异性抗体,同时靶向PD-L1/CD3/4-1BB/ROR1,目前正处于临床I期试验阶段。Systimmune在2023 AACR公布了GNC-035临床前结果表明,GNC-035具有介导 ROR1+ 癌症消退、克服基于TCR的免疫逃逸并逆转肿瘤微环境中T细胞免疫抑制的潜力 [4]。
3.5 单克隆抗体药物
Zilovertamab(以前称为cirmtuzumab或UC-961)是Oncternal Therapeutics研发的靶向ROR1的单克隆抗体药物,当它与ROR1结合时,可阻断WNT5A信号传导,进而抑制肿瘤细胞增殖、迁移和存活,诱导肿瘤细胞分化。
Oncternal Therapeutics已对 Zilovertamab 联合Imbruvica治疗MCL和慢性淋巴细胞白血病(CLL)和边缘区淋巴瘤 (MZL) 患者开展1/2期临床研究评估(NCT03088878)。此外,Zilovertamab还有两项正在开展的临床试验,一项是Zilovertamab联合Bcl-2 抑制剂Venetoclax治疗R/R CLL的2期临床试验 (NCT04501939);另一项是zilovertamab 联合 docetaxel治疗治疗转移性去势抵抗性前列腺癌的1b期临床试验 (NCT05156905)。
2023年4月,Oncternal Therapeutics宣布根据Bruton酪氨酸激酶抑制剂(BTK 抑制剂)快速变化的商业格局进行战略优先顺序调整,zilovertamab与ibrutinib联合的3期研究 ZILO-301和1/2期研究 CIRM-001* 将被关闭,以便将公司的现金跑道延长至2025年,并将重点放在ONCT-808和ONCT-534的临床开发上。公司强调,该决定并非基于对齐洛维他单抗的安全性或有效性的任何担忧。
4、缔码ROR1靶点产品助力新药研发
缔码是一家专注于提供可成药靶点临床前研发产品和服务的生物技术公司,拥有创新型功能膜蛋白开发、单B细胞先导抗体发现、抗体工程改造与功能验证平台。缔码现可提供ROR1靶点全系列产品与服务,产品涵盖多种属活性蛋白、流式验证单抗及参照抗体。服务涵盖人源化、亲和力成熟、PTM风险位点去除。另外,为了加速ROR1靶点药物研发,缔码还针对ROR1制备了B细胞种子库,最快20天可完成先导抗体分子筛选。
- 重组活性蛋白
Human ROR1 Protein, His Tag (PME100399)
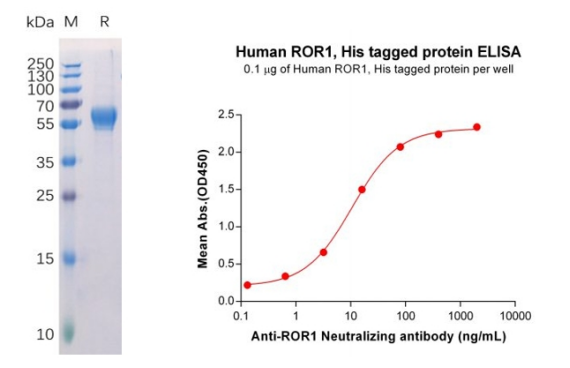
Figure 3. Validation data of purified Human ROR1 Protein, His Tag (PME100399). Human ROR1 Protein, His Tag on SDS-PAGE (left); ROR1 Protein (PME100399) can bind Anti-ROR1 Neutralizing antibody (BME100073) in a linear range of 0.64-16 μg/ml (right).
- 重组兔单抗
Anti-ROR1 antibody(DM149); Rabbit mAb (DME100149)
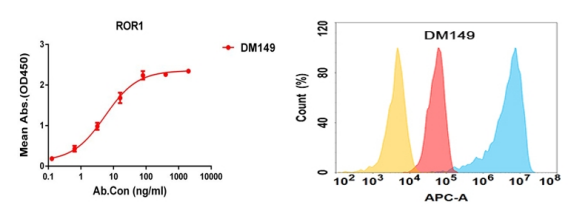
Figure 4. Validation data of Anti-ROR1 antibody (DME100149); Human ROR1 protein (PME100399) can bind Rabbit anti-ROR1 monoclonal antibody (DME100149) in a linear range of 1-50 ng/ml (left); Flow cytometry analysis with Anti-ROR1 (DME100149) on Expi293 cells transfected with human ROR1 (Blue histogram) or Expi293 transfected with irrelevant protein (Red histogram), and Isotype antibody on Expi293 transfected with irrelevant protein (Orange histogram) (right).
- ELISA&FC验证参照抗体
Anti-ROR1(NBE 002 biosimilar) mAb (BME100191)
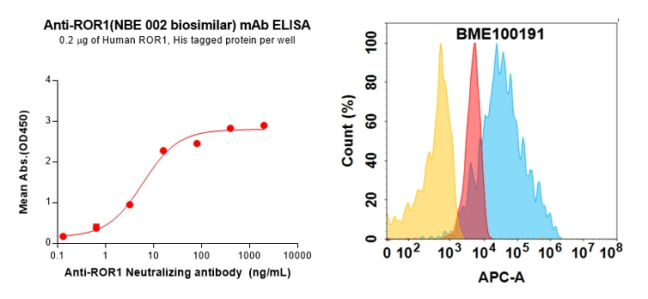
Figure 5. Validation data of Anti-ROR1(NBE 002 biosimilar) mAb (BME100191); Anti-ROR1(NBE 002 biosimilar) mAb (BME100191) can bind Anti-ROR1(NBE 002 biosimilar) mAb (BME100191) in a linear range of 0.64–16 ng/mL (left); Flow cytometry analysis with 1μg/mL Anti-ROR1(NBE 002 biosimilar) mAb (BME100191) on Expi293 cells transfected with Human ROR1 protein (Blue histogram) or Expi293 transfected with irrelevant protein (Red histogram),and isotype antibody on Expi293 transfected with irrelevant protein (Orange histogram) (right).
参考文献:
[1] Zhao Yuming, Zhang Dengyang, Guo Yao et al. Tyrosine Kinase ROR1 as a Target for Anti-Cancer Therapies. [J] .Front Oncol, 2021, 11: 680834.
[2] Karvonen Hanna, Barker Harlan, Kaleva Laura et al. Molecular Mechanisms Associated with ROR1-Mediated Drug Resistance: Crosstalk with Hippo-YAP/TAZ and BMI-1 Pathways. [J] .Cells, 2019, 8: undefined.
[3] Spencer Park, Courtney Simianer, Sydney Spadinger, et al; Abstract 2754: LYL797, a ROR1 CAR T-cell therapy with genetic and epigenetic reprogramming for solid tumors. Cancer Res 15 June 2022; 82 (12_Supplement): 2754.
[4] Jahan Salar Khalili, et al; Abstract 5679: Tetra-specific antibody GNC-035: guidance and navigation control (GNC) molecule development for treatment of ROR1+ malignancies. Cancer Res 1 April 2023; 83 (7_Supplement): 5679.
