目前已上市的CAR-T细胞疗法均只靶向单一的肿瘤抗原。在经过一段时间的治疗后,经常存在因肿瘤上抗原逃逸或异质抗原表达导致的肿瘤的复发。
为了解决这一限制,强生提出了以双特异性抗体分子(BsAb)作为中间的适配分子来连接CAR-T细胞和肿瘤细胞。
特点
双特异性抗体分子作为中间的适配器,可同时靶向CAR-T细胞上的G4S连接子和肿瘤细胞的TAA。通过连接CAR-T细胞到肿瘤细胞,增强CAR-T细胞的激活、增殖和肿瘤细胞溶解。
(G4S)n连接子存在于大多数临床上的CAR-T细胞表面的ScFv结构域中,连接VH和VL区域。这就使得该方法可以用于目前临床上的多数CAR-T细胞。
如下图1所示,一般情况下,CAR-T细胞通过胞外的scFv结构靶向肿瘤细胞上的TAA1,并杀死肿瘤细胞,患者的病情得到缓解。但是部分肿瘤细胞通过下调TAA1的表达实现逃逸,使得原有的CAR-T细胞失去作用。而双特异性抗体适配分子的加入,可以重新连接CAR-T细胞和肿瘤细胞,使得CAR-T细胞重新靶向该肿瘤细胞上新的抗原TAA2。
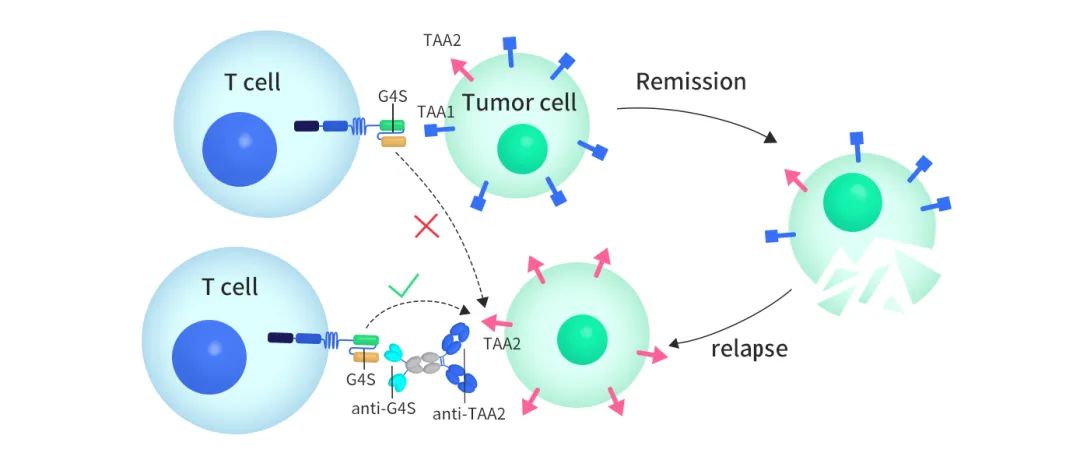
图1:双特异性抗体分子作为CAR-T适配分子的应用
该平台的优势
01安全性问题
双特异性分子作为CAR-T细胞和肿瘤细胞间的中间分子,可以控制CAR-T细胞的增殖和激活。可以通过调控加入的双特异性抗体剂量来调整CAR-T细胞的增殖和激活,从而控制潜在的毒性。这些都大大提高了CAR-T细胞的安全性。
此外,只有在特异性抗原存在的情况下,双特异性抗体才能有效激活CAR-T细胞。
01 在没有肿瘤细胞的情况下,BsAb存在与否并没有改变CAR的表面表达水平(图2)。
02 含有(G4S)4连接子的CAR-T细胞与表达PSMA的肿瘤细胞共培养时。
1.当BsAb存在时,CAR+CD8+细胞CD107a表达丰富高(表达总表达的21.2%);
2.BsAb不存在时,CAR+CD8+细胞的CD107a表达水平要低得多(1.2%)(图3)。这表明BsAb和肿瘤细胞同时存在是CAR-T细胞扩增、增殖和CD107a表达所必需的。
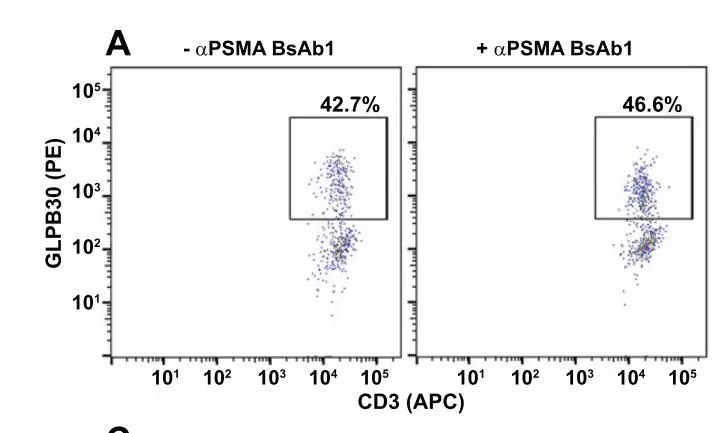
图2:BsAb的单独存在不会改变CAR表面表达
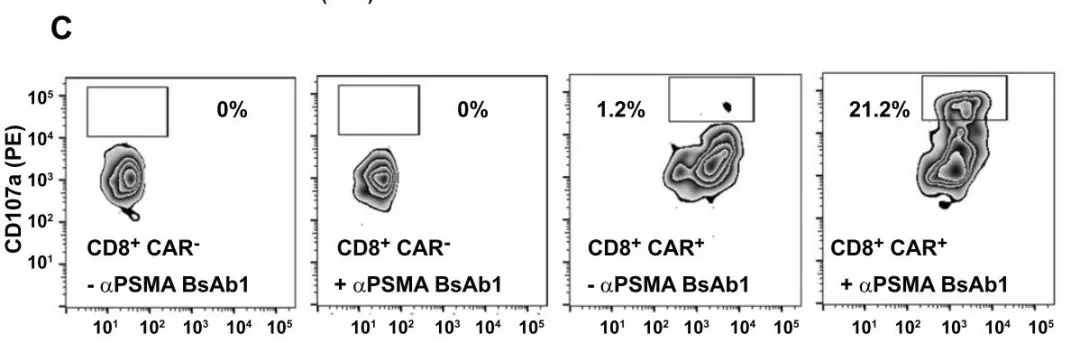
图3:BsAb1对CD107a表达的影响
(包含(G4S)4的CAR-T细胞与表达PSMA的肿瘤细胞共培养。在存在BsAb1和不存在BsAb1的情况下分别检测CD107a的表达)
02更广泛,灵活
一个针对(G4S)n连接子的适配分子能更广泛地适用于任何含(G4S)n的CAR-T细胞治疗。而(G4S)n又广泛存在于目前几乎所有的CAR-T细胞中,所以该平台的通用CAR-T可以提供更多的灵活性。
03重定向杀伤
在不改变T细胞上特异的scFv的情况下,可通过双特异性适配分子重新靶向新的TAAs。
因此,对于使用CAR-T细胞疗法后,因TAA缺失或下调而出现复发的患者,可以使用靶向(G4S)n的双特异性适配分子来重新定向新的TAAs,比如本研究中的靶向CD19的CAR-T细胞可通过BsAb可重新靶向表达PSMA的前列腺肿瘤细胞。
除了与现有的CAR-T细胞治疗结合使用外,靶向G4S的双特异性适配分子也可以用于缺乏TAA亲和力的CAR-T细胞(如本文中提到的带有3-23/B3的CAR)。
除此之外,该方法可以调整双特异性适配器的亲和力来探索细胞毒免疫的最佳特性。
参考文献:
[1]M. Jack Borrok, Yonghai Li, Paul B. Harvilla, et al. Conduit CAR: Redirecting CAR T-Cell Specificity with A Universal and Adaptable Bispecific Antibody Platform. Cancer Research Communications 10 March 2022; 2 (3): 146–157. https://doi.org/10.1158/2767-9764.CRC-21-0150