黏蛋白MUC1(Mucin1,又称MAM6和EMA)是一种表面粘蛋白,被发现在上皮来源的肿瘤组织(如肺癌、胰腺癌、前列腺癌、上皮性卵巢癌、乳腺癌等)中高表达,且其表达和肿瘤的转移、复发相关。目前,MUC1已经受到多家药企巨头的关注,包括第一三共、默克和齐鲁制药在内的药企大佬都对靶向MUC1的免疫疗法进行了管线布局。那MUC1究竟是什么?在肿瘤的发生发展中到底扮演什么角色?目前临床开发的药物类型又有哪些?
1、MUC1结构
MUC1基因位于染色体1q22上,由7个外显子和6个内含子组成。在人类中,MUC1基因通过选择性剪接可产生多种亚型。MUC1蛋白属于黏蛋白家族,是一种I型跨膜蛋白,主要包括细胞外区域、跨膜区和细胞质区。MUC1分子量为300-600kDa,是一种高分子量跨膜蛋白,由 MUC1-N和NUC1-C两个亚基组成。MUC1-N和NUC1-C通过非共价键连接,在细胞膜中形成异二聚体复合物。MUC1-N(N 端亚基)由外显子1-3编码,MUC1-C(C 端亚基)由外显子4-7编码。
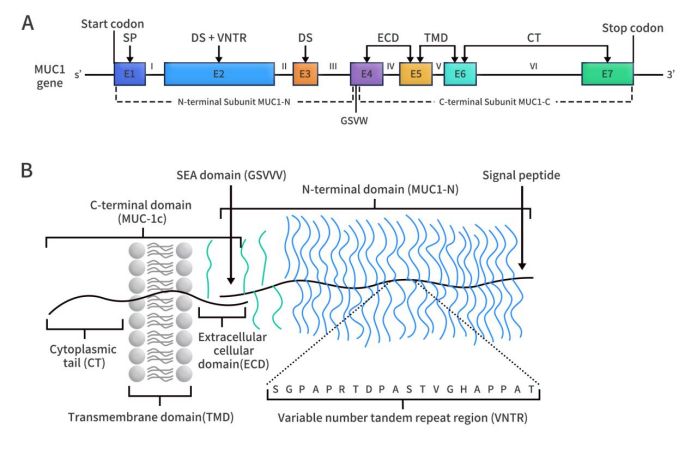
Figure 1. The structure of MUC1 gene (A) and protein (B) [1]
MUC1-N位于膜表面,是胞外氨基酸亚基。该亚基包含信号肽、可变数目串联重复序列 (VNTR) 区域和 SEA 结构域。VNTR区域由20个氨基酸序列的12-125个重复组成,每个重复有5个可能得O-糖基化位点(在丝氨酸和苏氨酸残基处Ser/Thr被O-糖基化)。VNTR区两侧是不完全重复(IR)序列,这些序列是与VNTR区相似的短并序列,也包含Ser/Thr残基;并含有少量天冬酰胺残基,该残基是N-连接糖基化位点 [2]。MUC1-C为C末端结构域,包含一个胞外结构域(ECD)、一个跨膜结构域(TMD)和一个无序细胞质结构域。ECD由58个氨基酸组成;TMD由28个氨基酸组成;无序细胞质结构域由72个氨基酸组成。其中,无序细胞质结构域包含一个CQC基序,这对于MUC1-C二聚体的形成及其进入细胞核至关重要。ECD含有一个N-糖基化位点,即天冬酰胺残基。根据N-糖基化的程度,MUC1-C的大小范围为23至25 kDa。缺乏N-糖基化的MUC1-C的分子量为17 kDa。
2、MUC1的表达与功能
在正常情况下,MUC1广泛分布于机体正常各黏膜表面,包括乳腺、食道、胃、十二指肠、胰腺、子宫、前列腺和肺的腺体或管腔上皮细胞的顶端表面;而且在造血细胞中也有较小程度上的表达 [3] [4]。它作为正常上皮组织的润滑剂保湿剂及物理屏障保护上皮细胞免受外界环境及污染物、微生物等的影响,同时还能介导信号转导和细胞粘附功能。广泛的O-糖基化和适度的N-糖基化是MUC1正常生物学功能的基础。VNTR中大约40%的氨基酸是丝氨酸 (Ser) 和苏氨酸 (Thr) 残基,它们会受到大量O-糖基化。N-糖基化发生在五个位点(均为天冬酰胺残基),其中四个位于MUC1-N的简并序列中,一个位于MUC1-C的ECD中。MUC1的糖基化模式根据糖基转移酶的组织特异性表达而变化[ 5]。O-糖基化与MUC1的生物学特性相关,而N-糖基化对于极化细胞中的蛋白质折叠、分选、分泌和顶端表达至关重要 [6]。在正常细胞中,MUC1是高度糖基化蛋白,肽核心会被糖链掩盖,从而保护其免受环境酶水解。此外,糖基化还通过防止粘蛋白经历网格蛋白介导的内吞作用来稳定细胞表面的粘蛋白[7]。
3、MUC1与肿瘤
在恶性肿瘤(乳腺癌、胃癌、多发性骨髓瘤等)组织中,MUC1的生化特征和细胞分布都与正常细胞中表达的不同。一般来说,恶性肿瘤中MUC1的表达量增高为正常的10倍以上,程度与肿瘤恶性程度成正比。结构上,糖链的糖基化不全,分支少,导致新糖链表位形成和肽链表位暴露,这使得MUC1受到细胞外蛋白酶切割并释放MUC1-N。MUC1-N的释放会诱导MUC1-C的构象变化,从而改变其配体状态,并随后激活下游细胞信号传导通路,如MAPK、PI3K/Akt和Wnt路径 [8]。同时,MUC1糖基化水平的降低也会导致肿瘤细胞粘附力下降,从而为肿瘤转移提供了条件。此外,MUC1的极性分布消失,整个腺上皮表面均表达MUC1,胞浆中也表达;这些MUC1通常靠近生长因子及其受体并与其相互作用,MUC1-C通过细胞内信号传导及相关生物分子的调节从而参与肿瘤细胞的侵袭、转移及血管生成等。
4、MUC1临床研究进展
基于MUC1在肿瘤发生进展中的作用和在肿瘤组织中的表达特征,MUC1被认为是实体瘤药物研发的潜力靶点。目前全球多家药企已针对MUC1靶点研发出进行多款免疫疗法进行布局,其中最快处于2期临床。在研MUC1靶向药药物类型多样,涉及抗体偶联药物(ADC)、单抗、双抗、疫苗、嵌合抗原受体T细胞(CAR-T)疗法和嵌合抗原受体自然杀伤细胞(CAR-NK)疗法。
4.1 MUC1-ADC
DS-3939,由第一三共和Glycotope合作开发,利用Glycotope的抗肿瘤相关MUC1(TA-MUC1)抗体和第一三共专有的DXd-ADC技术制备的ADC,DAR值为8。2023年9月,第一三共宣布,DS-3939正在在局部晚期、转移性或无法切除的实体瘤(如非小细胞肺癌、乳腺癌、尿路上皮癌、卵巢癌、胆道癌、胰腺导管腺癌)患者中开展的1/2期临床研究并完成首例患者给药。
M1231,由Sutro Biopharma和默克合作开发,是一款同时靶向MUC1和EGFR的双特异性ADC。M1231采用了Sutro非天然氨基酸定点偶联技术,利用可裂解的Val-Cit SUTRO链接子将双特异性抗体与细胞毒素Hemiasterlin相连。Hemiasterlin是一种三肽,可与微管蛋白结合发挥其细胞毒性。双特异性抗体部分通过默克的SEED双特异抗体技术平台防止两条重链的错配。其中靶向MUC1的抗体部分为scFv,而靶向EGFR的抗体部分为Fab形式。M1231于2021年开始临床,目前正处于临床Ⅰ期(NCT04695847),针对的适应症包括转移性实体瘤、食管癌和非小细胞肺癌。根据Clinical trial数据显示,该临床试验目前处于完成状态,但试验结果尚未披露。
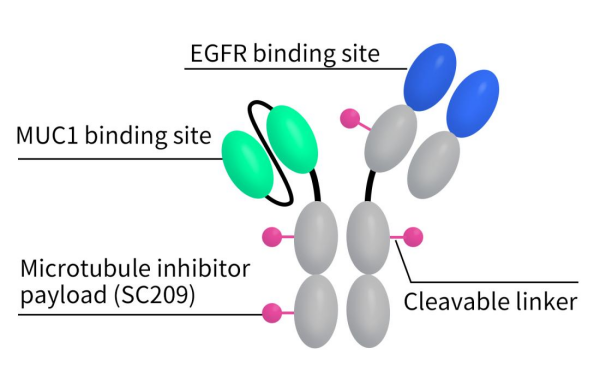
Figure 2. The structure of M1231
DXC-005,由多禧生物开发,是一款靶向MUC1的ADC。DXC-005由Tub201毒素小分子(Tubulysin B 类似物)和抗MUC1单克隆抗体偶联而成的,是国内获批临床的首款靶向MUC1的ADC新药,目前正处于临床I期招募阶段,针对结直肠癌及胰腺癌的治疗。
BM7PE,由奥斯陆大学医院开发,是一款由抗MUC1抗体BM7与假单胞菌外毒素A(PE)偶联的ADC药物。BM7PE目前正在进行转移性结直肠癌的1/2期临床试验(NCT04550897),该试验正处于招募状态。
DM002,由思道医药从百奥赛图引进,是一款靶向HER3和MUC1-C/ED的双特异性ADC药物。DM002靶向MUC1-C/ED避免了因MUC1-N脱落导致的抗体靶向肿瘤能力的降低。目前还处于临床前阶段。
4.2 MUC1 CAR-T
Anti-MUC1 CAR-T cell (Guangzhou Anjie Biomedical),由广州安捷生物医学技术公司开发的靶向MUC1的CAR-T疗法,目前正处于临床I/II期试验(NCT03706326),状态未知。
huMNC2-CAR44,由Minerva Biotechnologies开发,是一种用于实体瘤的自体CAR-T细胞疗法,靶向的是实体瘤癌细胞上的MUC1裂解形式。与正常的全长MUC1不同,MUC1裂解形式是有效的生长因子受体。目前,huMNC2-CAR44正在进行转移性乳腺癌的I期临床试验(NCT04020575),该试验还处于招募状态。
Tn-MUC1-CAR是由Tmunity Therapeutics开发的MUC1-CAR T细胞疗法。Tn-MUC1-CAR最初是由宾夕法尼亚大学Avery D. Posey博士领导的的一个研究小组开发的。该疗法靶向的是Tn (GalNAca1-O-Ser/Thr)和sialyl-Tn (STn) (NeuAca2-6-GalNAcal-O-Ser/Thr)糖基化MUC1。目前正在进行I期临床试验(NCT04025216),该试验的主要目的是确定CART-TnMUC1与淋巴清除联合使用的的安全性和2期推荐的剂量。目前显示的状态是终止,原因暂未揭露。
P-MUC1C-ALLO1是由Poseida Therapeutics开发的一种同种异体CAR-T细胞疗法,靶向表达MUC1细胞表面相关C末端抗原的癌细胞。目前正处于一项开放性剂量递增I期研究(NCT05239143)中,针对的适应症为晚期或转移性实体瘤,该试验目前还处在招募状态。2023年8月,安斯泰来和Poseida Therapeutics达成一项战略投资合作。据悉投资总金额为5000万美元,其中2500万美元用于一次性支付后者P-MUC1C-ALLO1项目的独家谈判权和优先许可权。
4.3 MUC1单抗
AR20.5是由OncoQuest开发的一款抗MUC1单抗,旨在激活肿瘤抗原MUC1特异的T细胞免疫应答,针对的适应症主要为胰腺癌。目前已经完成的FDA I期临床研究已建立与剂量和良好的安全性相关的生物活性。
4.4 MUC1疫苗
CVac是由Prima BioMed开发的一款用甘露糖基化MUC1蛋白诱导的自体单核细胞衍生DC。目前已经对这些细胞进行了两项2期临床研究:一项用于标准化疗后病情进展的晚期卵巢癌患者(NCT01521143),另一项用于卵巢癌患者临床缓解后的维持治疗(NCT02310971)。目前,NCT01521143试验已终止,NCT02310971已撤回。
ImMucin是由Hadassah Medical开发的一种21肽疫苗,包含MUC1蛋白的信号肽结构域,能够与各种MHC I类和II类等位基因结合。目前针对ImMucin已开展两项临床试验:一项是评估在MUC1+恶性肿瘤患者中ImMucin与GM-CSF联合用药的安全性与有效性的1/2期研究(NCT01232712),另一项是用于治疗表达MUC1多发性骨髓瘤患者的II期研究(NCT00162500),此项研究目前已撤回。NCT01232712研究表明,该疫苗具有安全耐受性,能够成功诱导了疫苗介导的细胞和体液免疫应答,11/15患者的临床疾病得到控制。
ONT-10是由Cascadian Therapeutics开发的一种脂质体治疗性疫苗,包含来自MUC1的20-mer合成糖肽与季戊四醇脂质a(TLR4激动剂)的两个重复组分。目前针对ONT-10开展的临床试验有三项:一项是在晚期卵巢癌和乳腺癌患者中进行了ONT-10与varlilumab(抗CD27激动性抗体)联合的Ib期研究(NCT02270372);一项是用于治疗实体瘤患者的I期研究(NCT01556789);还有一项是开放标签Ib期维持治疗研究(NCT01978964)。目前三项临床研究均已完成。
此外,处于临床阶段的MUC1疫苗还有默克开发的Tecemotide (L-BLP25,II期)、ImmunityBio开发的ETBX-061(II期)、Transgene开发的TG4010(II期)。
5、缔码MUC1相关产品与服务,助力MUC1生物疗法开发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供MUC1靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务包括多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速MUC1生物疗法的开发,缔码还制备了MUC1靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们也针对部分现有的MUC1先导抗体分子进行了CAR-T或ADC分子构建及功能验证,具体数据欢迎垂询。
- 多种属重组蛋白
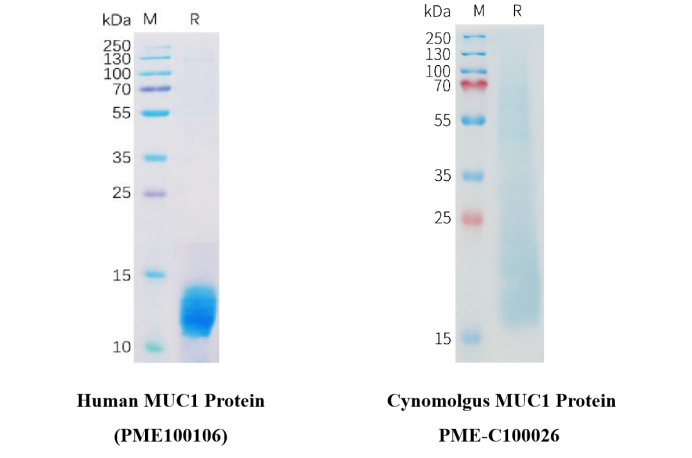
Figure 3. The purity of PME100106 is greater than 95% (left). The purity of PME-C100026 is greater than 85% (right).
- 流式验证抗体
Anti-MUC1 antibody(DMC493); IgG1 Chimeric mAb ( DMC100493)
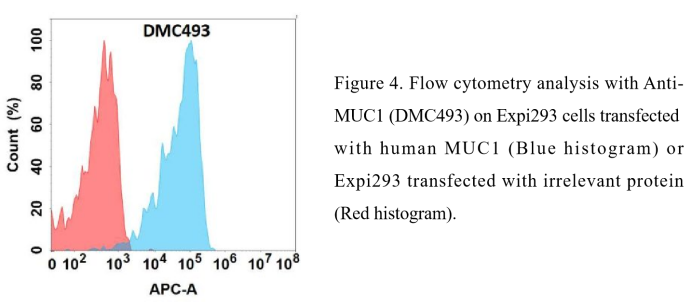
- MUC1产品列表
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100547 | Human MUC1 Protein, hFc Tag |
| 重组蛋白 | PME100106 | Human MUC1 Protein, HisTag |
| 重组蛋白 | PME-C100070 | Cynomolgus MUC1(380-500) Protein, mFc Tag |
| 重组蛋白 | PME-C100069 | Cynomolgus MUC1(380-500) Protein, hFc Tag |
| 重组蛋白 | PME-C100068 | Cynomolgus MUC1(24-504) Protein, His Tag |
| 重组蛋白 | PME-C100026 | Cynomolgus MUC1 Protein, His Tag |
| FC验证抗体 | DMC100493 | Anti-MUC1 antibody(DMC493), IgG1 Chimeric mAb |
| 参照抗体 | BME100059 | Anti-MUC1(gatipotuzumab biosimilar) mAb |
| 生物素标记抗体 | DMC100493B | Biotinylated Anti-MUC1 antibody(DMC493), IgG1 Chimeric mAb |
| 生物素标记抗体 | BME100059B | Biotinylated Anti-MUC1(gatipotuzumab biosimilar) mAb |
参考文献:
[1]Nath S, Mukherjee P. MUC1: a multifaceted oncoprotein with a key role in cancer progression. Trends Mol Med. 2014 Jun;20(6):332-42.
[2]Tong X, Dong C, Liang S. Mucin1 as a potential molecule for cancer immunotherapy and targeted therapy. J Cancer. 2024 Jan 1;15(1):54-67.
[3]Gendler SJ. MUC1, the renaissance molecule. J Mammary Gland Biol Neoplasia. 2001;6:339–353.
[4]Chang JF, et al. The epithelial mucin, MUC1, is expressed on resting T lymphocytes and can function as a negative regulator of T cell activation. Cell Immunol. 2000;201:83–88.
[5]Hattrup CL, Gendler SJ. Structure and function of the cell surface (tethered) mucins. Annu Rev Physiol. 2008;70:431–457.
[6]Parry S, et al. N-Glycosylation of the MUC1 mucin in epithelial cells and secretions. Glycobiology. 2006;16:623–634.
[7]Altschuler Y, et al. Clathrin-mediated endocytosis of MUC1 is modulated by its glycosylation state. Mol Biol Cell. 2000;11:819–831.
Hollingsworth MA, Swanson BJ. Mucins in cancer: protection and control of the cell surface. Nat Rev Cancer. 2004;4:45–60.
