2024年7月16日,临床前生物技术公司Courage联合创始人Roger Cone博士在《临床研究杂志(the Journal of Clinical Investigation)》上发表了题为“Subthreshold activation of the melanocortin system causes generalized sensitization to anorectic agents in mice”的研究。研究结果验证了GLP1RA和MC4R激动剂药物之间的协同作用,表明低剂量的MC4R激动剂可以显著改善GLP1RA药物的剂量反应性,从而减少食物摄入并通过一种新机制推动减肥,这种新机制可以在不增加副作用的情况下提高GLP1RA减肥效果。那MC4R究竟是什么?它在减肥过程中又扮演着什么样的角色呢?
1、MC4R与黑皮质素受体家族
黑皮质素4受体( MC4R)是黑皮质素受体家族成员之一,其家族成员还包括:MC1R、MC2R、MC3R和MC5R。该家族也是GPCR 超家族中具有重大治疗前景的一个亚家族,属于视紫红质样A类GPCR。黑皮质素受体 (MC1R-MC5R) 位于多种细胞类型上,并遍布大多数身体系统。MC1R和MC3R位于免疫细胞和相关的结构和支持细胞上,是直接影响免疫系统的关键受体。MC1R和MC3R与配体结合激活后,二者既能提供直接的抗炎作用,又能刺激促消退作用。MC4R主要在中枢神经系统中表达,在食物摄入等代谢的中枢调节中起着关键作用。MC5R存在于外分泌腺中,由眼部中的某些免疫活性细胞亚型表达。MC2R主要在肾上腺中表达,肾上腺的刺激与皮质醇的释放直接相关。
2、MC4R的结构与功能
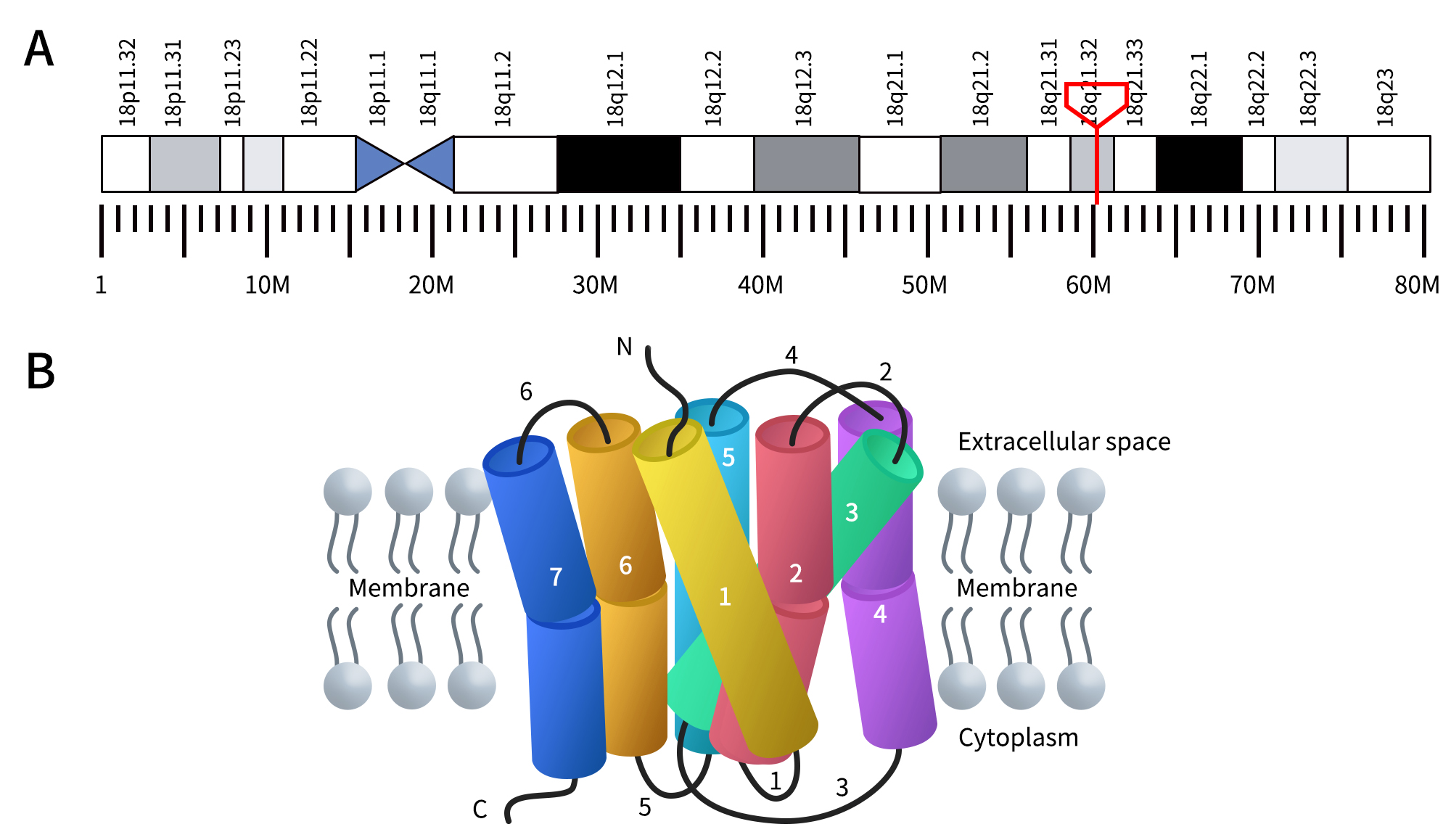
MC4R在人类中由位于18q21.32的MC4R基因编码,它编码MC4R蛋白,这是一种与α-黑素细胞刺激激素(α-MSH)结合的G蛋白偶联受体(GPCR)。与其他GPCR家族成员一样,MC4R蛋白也拥有七个跨膜结构域。这些跨膜结构域长度预计在21到27个氨基酸之间,由三个细胞外环和三个细胞内环连接,具有细胞外N端和细胞内C端。细胞外环(环2、4和6)长度在17到5个氨基酸之间。细胞内环(环1、3和6)长度在12到33个氨基酸之间[1]。

Figure 1. The Location of MC4R gene (A) and the structure of MC4R protein (B) [1] (The gene location is derived from WIKIPWDIA)
如前所述,MC4R主要在中枢神经系统中表达,是一种存在于大脑中控制食物摄入和能量平衡神经元上的受体,在调节食欲、饮食行为和体重方面发挥着关键作用。大脑中MC4R的激活通常会导致食物摄入量减少、能量消耗增加。相反,抑制MC4R则会导致食物摄入量增加、能量消耗减少。
3、黑皮质素-4受体MC4R信号通路
MC4R涉及的信号通路主要包括瘦素-黑皮质素通路、G蛋白信号通路、β-ARRESTIN通路和Ca2+调节途径。这些信号通路都与肥胖和能量代谢相关。

Figure 2. MC4R signaling pathways (A: Leptin melanocortin pathway [2]; B: G-protein signaling pathway[3]; C: β-arrestin signaling pathway[3]; D: Ca2+ regulated pathway[3])
3.1、瘦素-黑皮质素通路
在饱食状态下,脂肪组织会分泌瘦素,并激活弓状核中的瘦素受体(LEPR);瘦素与瘦素受体结合会刺激表达阿片黑皮质素原(POMC)神经元分泌α-黑素细胞刺激激素(α-MSH);α-MSH会结合并激活位于室旁核(PVN)中的MC4R,产生饱腹感信号,从而减少食欲,并产生增加能量消耗的信号;同时,MC4R可以抑制AgRP/NPY分泌MC4R反向激动剂刺风相关蛋白(AgRP),该肽由弓状核中的神经肽Y(NPY)神经元表达。而缺乏食物会诱导NYP/AgRP表达增加,从而产生饥饿信号[2]。
3.2、G蛋白信号通路
经典Gs通路和环磷酸腺苷(cAMP)的生成已被广泛研究用于肥胖相关/能量平衡问题,并且其机制已被相当了解。G蛋白是复杂的异三聚体鸟嘌呤结合蛋白,具有Gα、Gβ和Gγ亚基。α-MSH与MC4R结合导致G蛋白活化,αβγ-亚基解离成α-/βγ-亚基。解离的Gαs使腺苷酸环化酶(AC)活化,继而将ATP转化为环磷酸腺苷(cAMP);cAMP会进一步激活无活性的蛋白激酶A(PKA),后者转位到细胞核中,通过磷酸化CREB激活转录因子cAMP反应元件结合蛋白(CREB),从而调节转录[3]。
3.3、β-ARRESTIN通路
β-ARRESTIN通路是最近提出来参与MC4R调节,主要是针对MC4R突变引起的功能丧失/功能获得(GoF)。导致GoF的突变可能是利用了β-arrestin信号传导,尤其是那些与降低肥胖相关疾病风险的突变。有研究表明,MC4R突变有助于募集β-arrestin,尤其是V103I和I251L。突变的MC4R与其激动剂(如α-MSH或α-MSH类似物)结合后,可诱导受体构象发生变化,从而影响配受体间的结合。这种影响可能是通过强化配受体间的结合使MC4R不能内化至细胞内或者是加快MC4R再循环,从而使MC4R在质膜上保留更长时间;这会导致细胞内cAMP、PKA和cAMP调节鸟苷酸交换因子(Epac)增加[4][5]。
3.4、Ca2+调节途径
Ca2+是配体与MC4R结合的辅助因子。Ca2+可与α-MSH一起激活MC4R,从而诱导内向整流钾通道(KIR7.1)关闭以保持细胞内钾水平,这会导致整体的厌食效应,表现为饱腹感增强和食物摄入量减少。相反,AgRP可打开KIR7.1,导致K+流至细胞外,从而促进食欲[6][7][8]。
4、靶向MC4R药物临床研究进展
不完全统计,目前全球靶向MC4R在研药物共计32款,其中有2款获批上市,4款处于临床阶段,12款处于临床前阶段,7款已终止,7款处于无进展状态。涉及多种药物类型,包括小分子化药、合成多肽、生物药、CAR-T等,其中以小分子化药占比最高,合成多肽占比第二。
4.1、已上市的靶向MC4R药物
目前靶向MC4R的药物有2款已获批上市,二者都是合成多肽。Setmelanotide Acetate(又称为塞美拉肽),由Rhythm Pharmaceutical公司研发,于2020年底获批上市,是MC4R单靶点激动剂,此前已获得FDA批准的罕见肥胖症突破性药物,获批的适应症为Alstrom综合症、恶病质、缺乏瘦素、糖尿病、肥胖、遗传疾病等。Bremelanotide(又称为布美诺肽),由美国Palatin Technologies公司研发,于2019年获批上市,批准用于治疗绝经前妇女的全身性性欲减退症(HSDD)。Bremelanotide是MCR激动剂,对多种受体亚型有非选择性的激活作用,其活性依如下顺序递减:MC1R>MC4R>MC3R>MC5R>MC2R,在治疗剂量范围内,布美诺肽与MC1R及MC4R的结合率与剂量呈正相关。

4.2、处于临床阶段的靶向MC4R药物
目前处于临床阶段的靶向MC4R药物共有4款,其中,Rhythm Pharmaceuticals有两款,LB54640和RM-718分别处于临床2期和临床1期,二者均为NC4R激动剂;Pfizer有一款PF-07258669处于临床1期,是一种MC4R拮抗剂;Endevica Bio有一款TCMCB-07处于临床1期,是一种MC4R拮抗剂。

LB54640是由LG Chem自主研发的一款口服MC4R激动剂,主要用于治疗罕见遗传性肥胖症。2024年1月,LG Chem宣布向Rhythm Pharmaceuticals转让LB54640的全球开发及销售权许可,项目预付款为1亿美元,总合同规模达3.05亿美元。目前,该药正在针对下丘脑性肥胖症患者开展2期临床试验(NCT06046443)。该研究计划招募28名先天性及后天性下丘脑功能受损、难以控制食欲、12岁以上的下丘脑性肥胖症患者。研究将分析受试者服用药物第14周时的体质指数(BMI)变化值,以及长期服用52周之后的药物安全性等。试验从2024年7月11日开始,预计到2026年初结束。除了LB54640,Rhythm Pharmaceuticals还同步在临床上推进具有更高选择性的RM-718激动剂项目(NCT06239116)。
PF-07258669是由辉瑞开发的一款强效、选择性MC4R拮抗剂,在老年大鼠恶病质模型中具有显著的药效,辉瑞分别在美国和比利时开展临床I期试验(NCT04628793和NCT05113940)。
TCMCB07是由Endevica Bio开发的一款用于治疗恶病质的MC3R/MC4R拮抗剂候选肽,可穿过血脑屏障并作用于以前无法进入的靶受体,以调节身体对慢性疾病的行为和代谢反应。2022年11月,Endevica Bio宣布TCMCB07治疗恶病质的Ⅰ期单剂量递增(SAD)试验中,取得了初步积极成果。该研究旨在评估TCMCB07在健康志愿者中的安全性、耐受性和药代动力学。多剂量递增(MAD)试验正在进行,预计将于2022年12月底完成。
4.3、临床无进展&终止的靶向MC4R药物
目前在临床阶段终止的靶向MC4R药物共有4款,临床阶段无进展的有2款。其中,AstraZeneca的AZD-2820是因在Ⅰ期实验中发生严重不良反应,于2012年宣布停止开发。

此外,还有12款处于临床前阶段,详情如下表所示:

5、缔码生物全长MC4R活性蛋白助力药物研发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码生物利用自主研发的Synthetic Nanodisc膜蛋白表达技术平台已开发出全长的人MC4R蛋白。与市面上大多数MSP(膜支持蛋白)Nanodisc不同,缔码生物研发的Synthetic Nanodisc是基于真核表达系统,能直接从完整的细胞中制作。在这个过程中,使用的合成高分子具有双重功能。首先,它溶解细胞膜,类似于洗涤剂,然后利用天然细胞磷脂在膜蛋白周围形成纳米盘结构。跨膜蛋白可整合到Nanodiscs中。

目前,缔码生物已利用Nanodiscs全长膜蛋白平台开发了数百种膜蛋白,点击这个可查看所有膜蛋白。
Human MC4R full length protein-synthetic nanodisc (FLP100122)

[Right] ELISA plates were pre-coated with Flag Tag MC4R-Nanodisc (0.2μg/per well). The EC50 for anti-Flag monoclonal antibody binding with MC4R-Nanodisc is 1.957ng/ml.
此外,基于缔码生物单B细胞抗体发现、缔码功能膜蛋白开发、抗体工程改造与功能验证平台,缔码生物还可提供多种属蛋白抗体定制服务、抗体人源化亲和力成熟服务及先导分子发现服务。具体服务详情,欢迎致电垂询。
参考文献:
[1] Neocleous V, Shammas C, Phelan MM, et al. A novel MC4R deletion coexisting with FTO and MC1R gene variants, causes severe early onset obesity. Hormones (Athens). 2016 Jul;15(3):445-452.
[2] Chermon, D.; Birk, R. Predisposition of the Common MC4R rs17782313 Female Carriers to Elevated Obesity and Interaction with Eating Habits. Genes 2023, 14, 1996.
[3] Fatima MT, Ahmed I, Fakhro KA, et al. Melanocortin-4 receptor complexity in energy homeostasis,obesity and drug development strategies. Diabetes Obes Metab. 2022 Apr;24(4):583-598.
[4] Brouwers B, de Oliveira EM, Marti-Solano M, et al. Human MC4R variants affect endocytosis, trafficking and dimerization revealing multiple cellular mechanisms involved in weight regulation. Cell Rep. 2021; 34(12):108862.
[5] Lotta LA, Mokrosiński J, Mendes de Oliveira E, et al. Human gain-of-function MC4R variants show signaling bias and protect against obesity. Cell. 2019; 177(3): 597-607.e9.
[6] Yu J, Gimenez LE, Hernandez CC, et al. Determination of the melanocortin-4 receptor structure identifies Ca2+ as a cofactor for ligand binding. Science. 2020; 368(6489): 428-433.
[7] Chaturvedi M, Shukla AK. Calcium as a biased cofactor. Science. 2020; 368(6489): 369-370.
[8] Ghamari-Langroudi M, Digby GJ, Sebag JA, et al. G-protein-independent coupling of MC4R to Kir7.1 in hypothalamic neurons. Nature. 2015; 520(7545): 94-98.