上篇我们给大家介绍了免疫共刺激受体家族中的B7配体和CD28受体家族,及其成员 CD28,今天我们继续来介绍下另一个免疫共刺激受体相关超家族:肿瘤坏死因子(TNF)和肿瘤坏死因子受体(TNFR)超家族(TNFSF/TNFRSF),及代表成员CD27L和CD27。
1、TNFSF / TNFRSF概述
肿瘤坏死因子(TNF)和TNF受体(TNFR)超家族(TNFSF/TNFRSF)包括19个配体和29个受体。
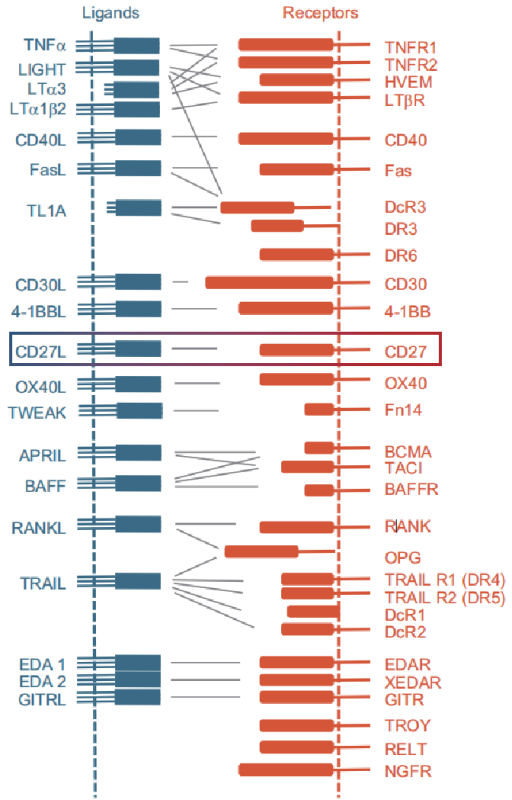
(数据来源 Dostert C, et al. Physiol Rev. 2019)
TNF配体超家族(TNFSF)是II型跨膜蛋白(细胞内N端),具有自组装,非共价结合的三聚体的生物学活性;TNF受体超家族(TNFRSF)是I型跨膜蛋白,其特征在于富含半胱氨酸的结构域(CRD),这是TNFR超家族的标志。这些TNFSF配体和TNFRSF受体之间的相互作用介导了控制免疫细胞和非免疫细胞的存活,增殖,分化和效应子功能的信号传导。TNF/TNFR超家族成员已成为针对人类疾病(例如自身免疫性疾病,骨质疏松症和癌症)疗法的重要靶标。
2、CD27/CD27L靶点
肿瘤坏死因子受体超家族成员7(TNFRSF7,CD27,由T、B和NK细胞及其前体直接表达)及其唯一已知配体CD27L(TNFSF7,CD70,仅在免疫细胞(树突状细胞DC,B细胞,调节性T细胞,NK细胞)激活后组成型表达)提供促进T细胞活化,分化和存活的共刺激信号,产生功能性免疫应答。
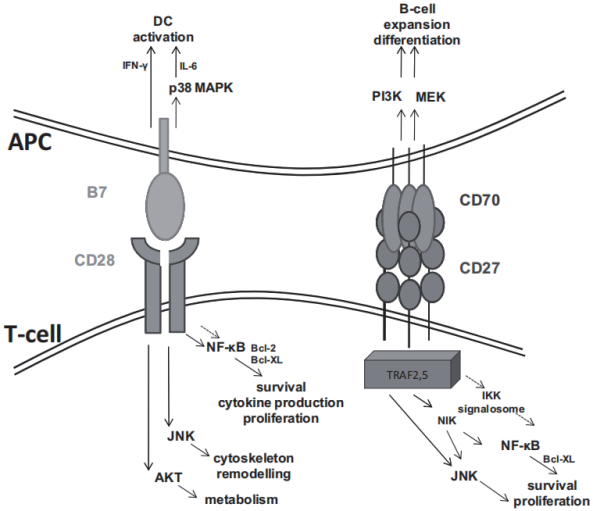
(数据来源 Denoeud J, et al. J Leukoc Biol. 2011)
这是不是跟 CD28/B7-1(CD80)/ B7-2(CD86)信号途径很像?两者也确实有关联:当 T 细胞受体(TCR)识别抗原呈递细胞(APC)上的肽/MHC复合物,CD80/CD86被上调并且新诱导表达CD70,这些配体分别触发CD4+和CD8+T细胞上的CD28和CD27,从而引起细胞毒性T淋巴细胞(CTL)反应,从而消除所有肿瘤细胞。
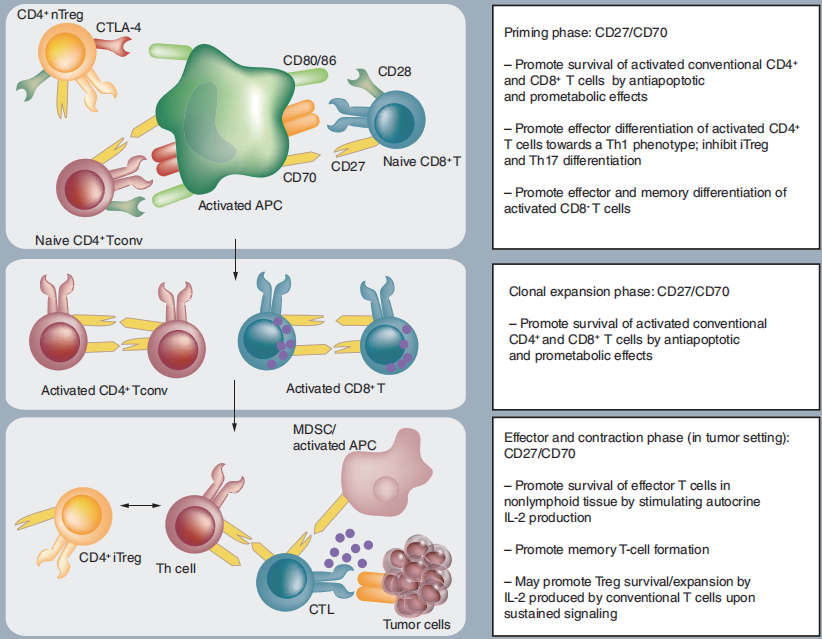
(数据来源 van de Ven K, et al. Immunotherapy. 2015)
CD27 的激动性刺激是免疫肿瘤学中有希望的治疗概念,旨在增强和维持 T 细胞驱动的抗肿瘤应答。
3、CD27靶点开发
目前临床试验上CD27靶向药物都为激动剂抗体,而且主要集中在Celldex Therapeutics和Aduro两家公司。

(数据来源 clinicaltrials, 各公司官网)
- Celldex Therapeutics & Varlilumab
Celldex Therapeutics(塞德斯医疗公司)是美国新泽西一家生物制药公司,旗下Varlilumab为抗CD27单克隆IgG1抗体。

从Varlilumab临床试验上我们能窥见该公司的治疗策略:通过结合不同治疗方法来最大程度地发挥免疫系统反应的优势,不断优化组合,从而为多种疑难杂症开发特定的方案。但这种大量组合方案也浪费了很多资源精力,加上18年Celldex在Glembatumumab vedotin(靶向gpNMB的ADC)上试验的失败,公司发展受挫,所以终止了Varlilumab多项试验,目前官网也未将其列为开发管线之中。
Varlilumab 临床数据补充:I 期研究评估了 56 名血液肿瘤和晚期实体瘤(包括转移性黑素瘤,肾细胞癌,前列腺癌,卵巢癌,结直肠癌和非小细胞肺癌)患者的安全性和剂量(NCT01460134):15 例转移性肾细胞癌患者中有 1 例达到部分缓解,肿瘤缩小率为78%,无进展生存期(PFS)为2.3年,8/56(14.29%)例患者病情稳定3.8‒47.3个月;19例经过高度预处理的晚期 B 细胞淋巴瘤患者中,有1例获得了完全缓解(CR)。在I /II期剂量递增和队列扩展研究(NCT02335918)中,与nivolumab联合用于不同的实体恶性肿瘤(n=175例患者):到目前为止,仅对结直肠癌和卵巢癌可获得结果,表明5/49(10%)的卵巢癌患者达到了部分缓解(PR),而19/49(39%)达到了稳定(SD)。
- Celldex Therapeutics & CDX-527
基于 Varlilumab 作为单一疗法并与 PD-1抑制剂联用的先前临床数据经验,Celldex接下来也优化了另一种方案:开发了CD27&PD-L1双特异性抗体CDX-527,将CD27共刺激与PD-L1/PD-1途径的阻断相结合,以帮助通过CD27共刺激来引发和激活抗肿瘤T细胞应答,同时防止PD-1抑制信号破坏了免疫反应。临床前数据证明CDX-527在抗T细胞活化和抗肿瘤活性方面比抗PD-L1和抗CD27抗体更有效。Celldex已开始CDX-527对实体瘤患者进行开放标签的1期研究。
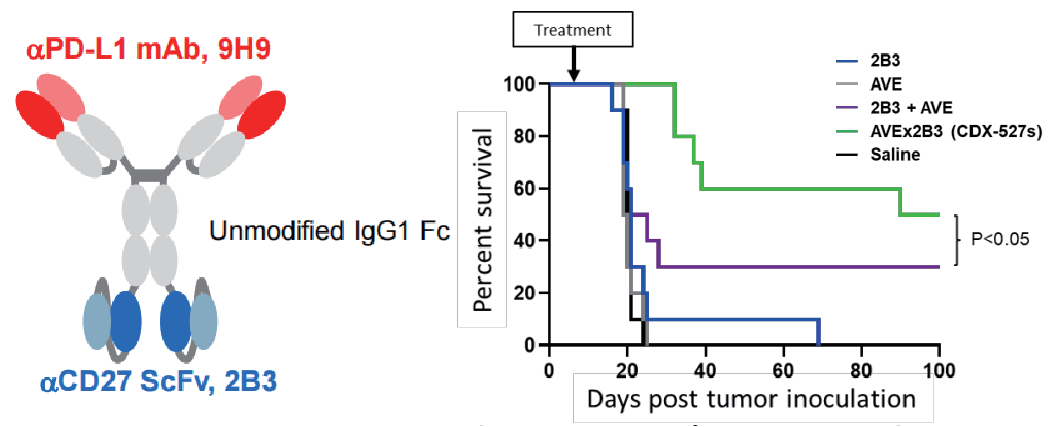
(数据来源 Celldex 官网)
- Aduro BioTech & MK-5890
Aduro BioTech成立于2000年,总部位于加利福尼亚州伯克利,是一家研发针对胰腺癌免疫疗法的公司。2020年底Aduro与加拿大开发和商业化用于肾脏疾病的精准药物的生物技术公司Chinook Therapeutics合并,改称Chinook Therapeutics。

基于其单B细胞筛选单克隆抗体技术平台,开发了抗CD27激动剂单抗MK-5890,根据早先与默克的全球许可协议,2020年初Aduro获得了1000万美元的开发里程碑付款,启动了MK-5890治疗非小细胞肺癌(NSCLC)的I期临床试验,这里也是联合用药的思路(与PD-1阻断单抗可瑞达联用)。
4、CD27小结
从 Varlilumab 和 MK-5890 开发经验中,我们可以看出虽然单独使用 CD27 激动剂抗体也非常有疗效,但引起 CD4+ 和 CD8+T 细胞的耗竭,并不能最大化治疗作用,联合使用多种替代的抗肿瘤活性协同机制可更大增强功效,或许开发 CD27 相关多特异性抗体是一种更好的选择。就像再生元和赛诺菲开发的 CD28 多特异性抗体重新让 CD28 靶点焕发新生一样。
5、缔码生物CD27产品助力药物研发
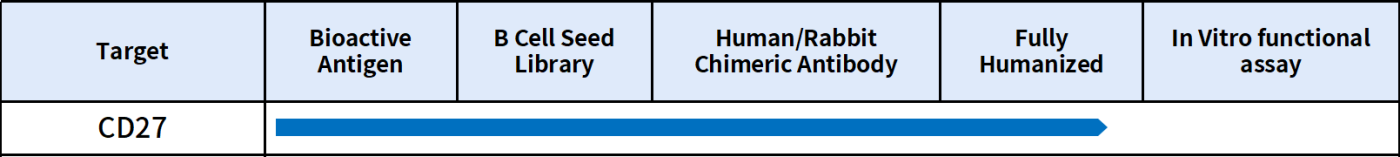
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供CD27靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务涵盖多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速CD27生物疗法的开发,缔码还制备了CD27靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们目前已筛选出15个CD27抗体分子,其中有6个分子完成人源化,客户第二天可以拿到分子进行功能评估验证,详情欢迎垂询。
- 重组蛋白&抗体&稳转细胞株&CDX切片产品
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100013 | Human CD27 Protein, mFc-His Tag |
| PME100475 | Human CD27 Protein, hFc Tag | |
| PME-M100011 | Mouse CD27 Protein, hFc Tag | |
| 流式抗体 | DME100059 | Anti-CD27 antibody(DM59), Rabbit mAb |
| DME100058 | Anti-CD27 antibody(DM58); Rabbit mAb | |
| DME100057 | Anti-CD27 antibody(DM57); Rabbit mAb | |
| 参照抗体 | BME100018 | Anti-CD27 (varlilumab biosimilar) mAb |
| 生物素标记抗体 | DME100057B | Biotinylated Anti-CD27 antibody(DM57); Rabbit mAb |
| DME100058B | Biotinylated Anti-CD27 antibody(DM58); Rabbit mAb | |
| DME100059B | Biotinylated Anti-CD27 antibody(DM59); Rabbit mAb | |
| BME100018B | Biotinylated Anti-CD27 (varlilumab biosimilar) mAb | |
| 稳转细胞株 | CEL100081 | Hu_CD27 CHO-S Cell Line |
| CDX切片 | SLI100013 | M-NSG RAJI DiSliceX™ SlideSet |
- 缔码生物CD27先导分子研究进展