9月17日,第一三共和默沙东共同宣布,patritumab deruxtecan,一种潜在同类首创靶向HER3的DXd抗体ADC,3期肺癌临床试验HERTHENA -Lung02达到了无进展生存期(PFS)的主要终点。与铂类加培美曲塞诱导化疗和培美曲塞维持化疗相比,有统计学上显著改善。这也进一步验证了HER3靶点的在肺癌治疗中的可成药性。那目前靶向HER3药物临床进展如何?布局药企又有哪些?
1、HER3/ERBB3结构
人类表皮生长因子受体3(HER3),也称为受体酪氨酸蛋白激酶ERBB3,是一种膜结合蛋白,属于ERBB/HER受体酪氨酸激酶(RTK)家族。在哺乳动物中,有四种ERBB/HER受体,分别是:EGFR (ERBB1/HER1)、HER2(ERBB2)、HER3(ERBB3)和HER4(ERBB4)。多项研究表明,ERBB/HER受体在动物发育过程中发挥关键作用,其功能改变可能导致某些类型肿瘤的病理生理发展[1][2]。其中,HER3因其在非细小细胞癌(NSCLC)发病机制中的独特作用及其对患者预后的影响而越来越受到重视。
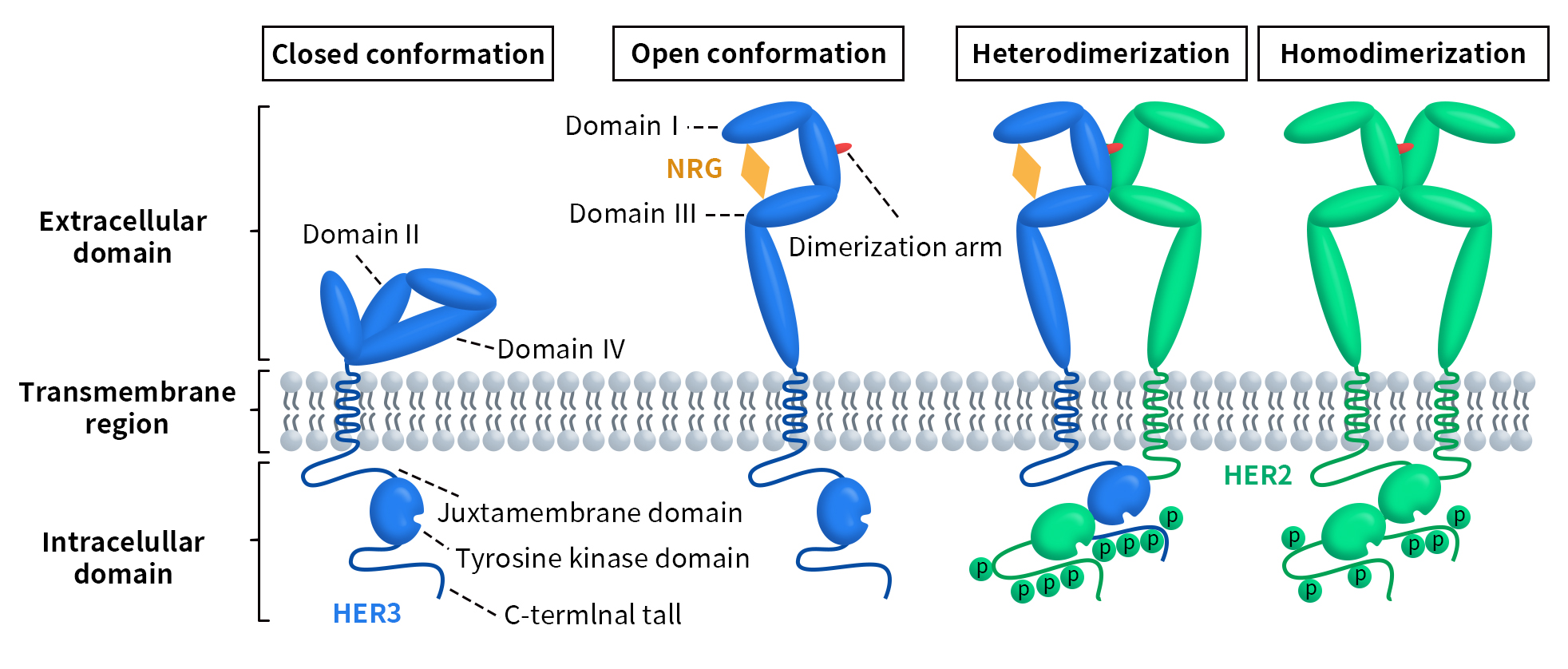
HER3由Kraus等人于1989年发现[3],在人类中由位于12q13染色体的ERBB3基因编码。该基因包含23,651个碱基对,编码的HER3蛋白包含1342个氨基酸。与其他ERBB受体酪氨酸激酶家族成员一样,HER3蛋白包含一个胞外域、一个跨膜结构域和一个胞内域。其中,胞外域又由四个亚结构域 (I-IV) 组成,亚结构域I和III富含亮氨酸,主要参与配体结合。亚结构域II和IV富含半胱氨酸,很可能通过形成二硫键来促进蛋白质构象和稳定性。亚结构域II还包含二聚体形成所需的二聚化环。胞内域包含近膜结构域、酪氨酸激酶结构域和具有可磷酸化残基的C末端尾部 [4] [5]。
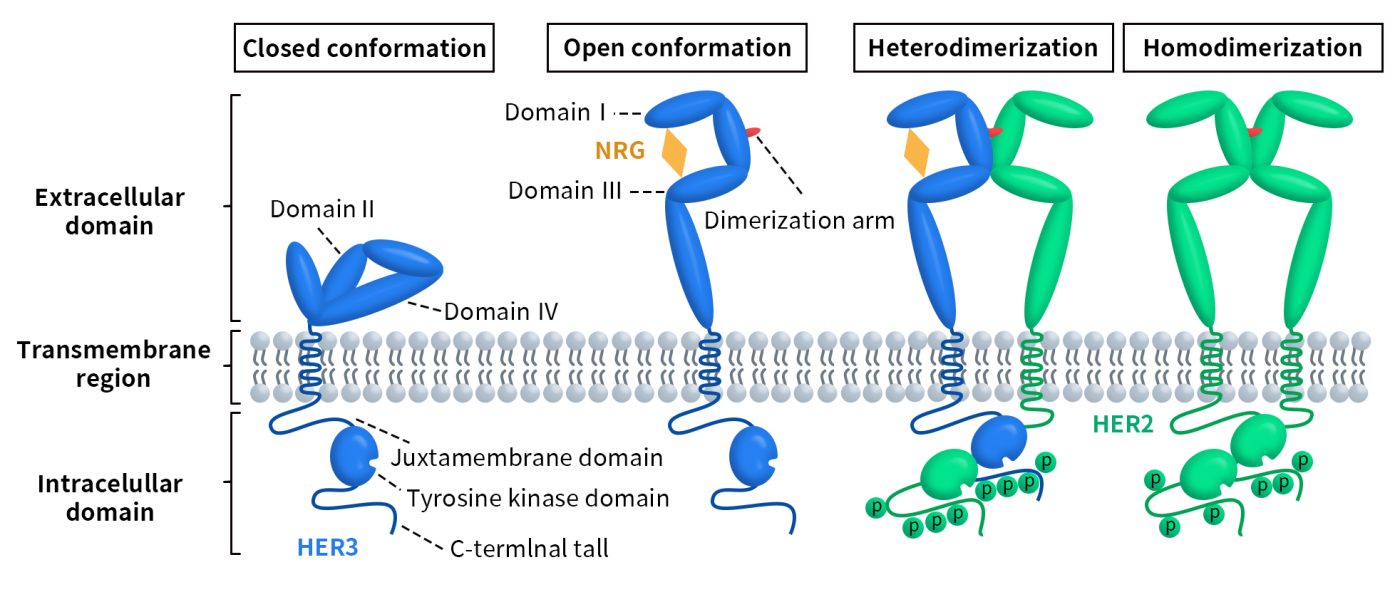
Figure 1. Schematic representation of the structural changes and activation of ERBB/HER receptors [6]
HER3能与配体heregulin和神经调节蛋白(NRG2)结合。如Figure 1所示,在没有配体的情况下,亚结构域II和IV之间的直接分子内相互作用使HER3处于无活性构象;当配体与子亚结构域I和III结合时,会诱发HER3胞外结构域的构象变化,使位于亚结构域II中的二聚化臂暴露在外。二聚化臂可以使HER3与另一个ERBB RTK成员或HER3单体进行分子间互作,形成异二聚体或同质二聚体[7][8]。
2、HER3/ERBB3信号通路
HER3 广泛表达于人类成人组织,包括胃肠道、泌尿道、呼吸道、生殖道、皮肤、内分泌和神经系统的细胞。与其他ERBB受体酪氨酸激酶家族成员不同,它们在与配体结合后可以通过自身磷酸化而被激活,而ERBB3存在激酶缺陷,其自身磷酸化活性仅为EGFR的1/1000,并且没有磷酸化其他蛋白质的能力[9]。如前所述,HER3的胞外域与配体结合后,会呈现活性构象。由于HER3存在激酶缺陷,所以HER3只能进行弱的自身磷酸化。不过,HER3可以与其他受体酪氨酸激酶(RTK)形成异二聚体,从而有效地实现胞质域的磷酸化。HER3的主要二聚化伙伴是HER2。当异二聚体形成时,MAPK通路和AKT通路都会被激活,这两条通路的激活可调控参与多种细胞反应的基因,例如细胞周期控制、增殖、存活、代谢、细胞凋亡和血管生成。 另外,HER3本身也会受到不同水平的调控,比如:2种泛素连接酶NEDD4和NRDP1可介导其泛素化和蛋白酶体降解。受AKT调控的去泛素化酶USP8可负向调控 NRDP1。活化的雄激素受体(AR)也通过与NRDP1启动子区域结合并激活NRDP1转录来控制 HER3水平。
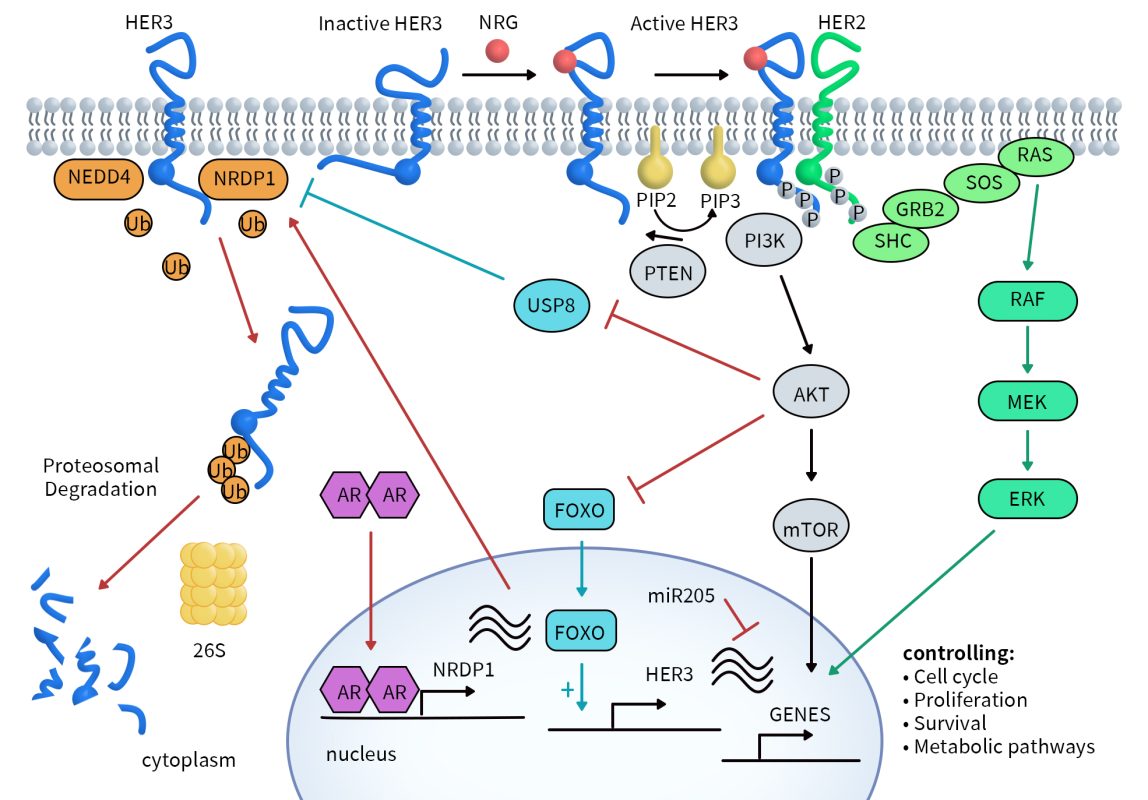
Figure 2. Regulation of HER3 and downstream signaling [10]
3、靶向HER3药物临床研究进展
虽然没有证据表明HER3过表达、组成性激活或突变本身会致癌,但其作为HER2的二聚体伙伴,与生长、增殖、化疗耐药以及促进侵袭和转移有关。目前已在多种类型肿瘤中发现HER3表达或过表达,比如乳腺癌、卵巢癌、肺癌、结肠癌、胰腺癌、黑色素瘤、胃癌和头颈癌等。目前,靶向HER3的药物共计有113款,其中临床前阶段药物数量最多,达到56种;临床2期和临床1期药物数量较少,分别为8种和7种。不过已经申请上市和临床申请批准的药物各有1种,这也表明该赛道具有较高的可行性。处于临床阶段的靶向HER3药物类型也呈现多样化的特点,包含ADC、单克隆抗体、双特异性抗体和疫苗等,其中ADC药物数量占绝对主导地位。
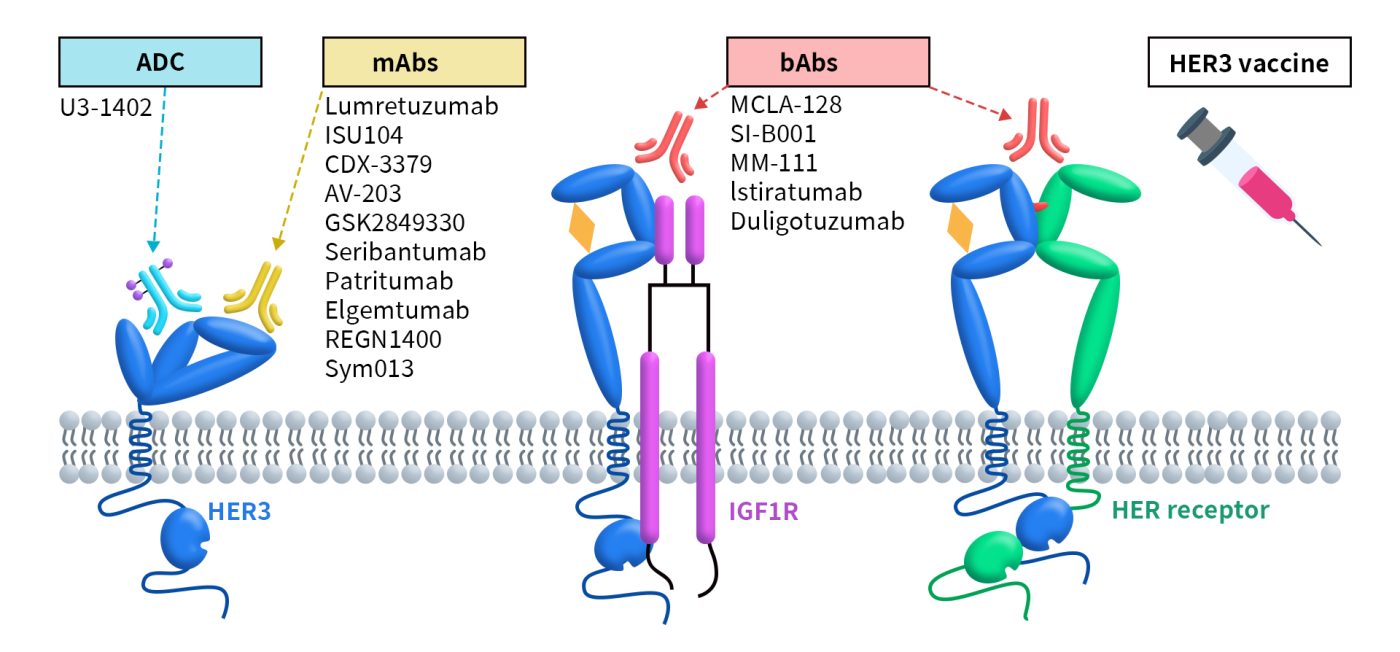
Figure 3. Therapies against HER3 under clinical development [6]
3.1 HER3 ADC药物
不完全统计,目前全球靶向HER3的ADC药物共计有43款,其中有62.7%(27款)处于临床前阶段,处于临床阶段占总数的23%(10款),目前暂未有获批上市的药物,最高研发阶段为临床3期,药物详情及布局企业如下表所示:

- 伦康依隆妥单抗
伦康依隆妥单抗,又称为BL-B01D1,是由四川百利天恒子公司Systimmune开发的一款基于双特异性拓扑异构酶抑制剂(Ed-04)的ADC药物,是全球首个进入临床阶段的双靶点EGFR&HER3抗体偶联药物,其DAR值在7.5和8之间。四价BL-B01D1具有两个结合域,用于不同的生长因子受体,可驱动癌细胞增殖和存活。BL-B01D1可阻断EGFR和HER3向癌细胞发出的信号,从而减少增殖和存活信号。在抗体介导的内化后,BL-B01D1会运送到癌细胞溶酶体并释放其治疗有效载荷,从而诱导导致癌细胞死亡的基因毒性应激激活途径。2023年12月,百利天恒以8亿美元首付款,潜在总价值最高达84 亿美元,将BL-B01D1 授权给BMS,根据协议,BMS将独家负责BL-B01D1在除中国大陆外全球其他地区的开发和商业化。
目前,BL-B01D1已启动7项3期临床。分别是:BL-B01D1-301(NCT06382116)针对伴有EGFR敏感突变的局部晚期或转移性非鳞状非小细胞肺癌,经EGFR-TKI治疗,对比铂类化疗;BL-B01D1-302(NCT06382129)针对局部晚期或转移性EGFR野生型非小细胞肺癌,经过抗PD-1/PD-L1单克隆抗体+铂类化疗,对比多西他赛;BL-B01D1-303(NCT06118333)针对复发性或转移性鼻咽癌,PD-1/PD-L1单克隆抗体作为最后一线治疗+至少两线铂类化疗,对比化疗(多西他赛、卡培他滨、吉西他滨);BL-B01D1-304(NCT06500026)针对复发性小细胞肺癌,经过抗PD-1/PD-L1单克隆抗体和铂类化疗,对比拓扑替康。BL-B01D1-305(NCT06304974)针对复发性或转移性食管癌,PD-1/PD-L1+铂类化疗失败后,对比化疗(伊立替康、紫杉醇、多西他赛);BL-B01D1-306(NCT06343948)针对局部晚期复发性或转移性HR+/HER2-乳腺癌,至少经过一种化疗治疗,对比化疗(艾日布林、长春瑞滨、卡培他滨、吉西他滨);BL-B01D1-307(NCT06382142)针对无法切除的局部晚期或转移性三阴性乳腺癌,经过紫杉醇类药物治疗,对比化疗(艾日布林、长春瑞滨、卡培他滨、吉西他滨)。
- 德帕瑞妥单抗
德帕瑞妥单抗,也称为U3-1402,是第一三共制药研发的一种靶向HER3的抗体偶联药物(HER3-DXd)。U3-1402由完全人源化抗HER3 IgG11单克隆抗体通过四肽可裂解连接物与拓扑异构酶I抑制剂共价连接,DAR值为7.8。目前由第一三共和默沙东共同开发和商业化。2024年9月17日,默沙东和第一三共宣布,patritumab deruxtecan治疗既往接受过EGFR-TKI治疗的局部晚期或转移性EGFR突变非小细胞肺癌(NSCLC)患者的III期HERTHENA-Lung02研究(NCT05338970)达到了无进展生存期(PFS)的主要终点。与铂联合培美曲塞诱导化疗后再接受培美曲塞维持化疗相比,patritumab deruxtecan治疗后患者实现显著的PFS统计学改善。早在2023年12月,FDA基于II期HERTHENA-Lung01研究受理patritumab deruxtecan的生物制品许可申请(BLA)并授予其优先审评资格,用于治疗既往接受过两种或两种以上全身治疗的局部晚期或转移性EGFR突变NSCLC成人患者。2024年6月,第一三共和默沙东收到FDA就该BLA发出的完整回复函(CRL),其上市申请被FDA延期批准,原因是第三方生产设施的问题。
此外,HER3 ADC药物还有恒瑞医药的HR-A2009、宜联生物的YL202、映恩生物的DB-1310、信达生物的IBI133等。其中,SHR-A2009于2024年1月获得FDA授予快速通道资格,用于治疗经第三代EGFR酪氨酸激酶抑制剂和含铂化疗后疾病进展的EGFR突变的转移性NSCLC。
3.2 HER3双特异性抗体
不完全统计,目前全球靶向HER3的双特异性抗体共计有12款,其中有5款处于临床前阶段,处于申请上市阶段的药物有1款,临床3期的也仅有1款,其余的为无进展和终止状态。

- Zenocutuzumab
Zenocutuzumab,又称为Zeno或MCLA-128,是由Merus NV开发的一款靶向HER2/HER3的双特异性抗体。该双抗主要是通过与HER2特异性结合并有效阻止HER3与NRG1或NRG1融合蛋白的相互作用,显示出对NRG1+癌症的潜在疗效。2023年6月,FDA已授予Zeno突破性疗法认定;2024年5月,美国FDA接受了Zenocutuzumab的生物制品许可申请(BLA),并授予其优先审评资格,用于治疗神经调节蛋白1融合阳性(NRG1+)非小细胞肺癌(NSCLC)和胰腺癌(PDAC)患者。Merus首席医疗官Andrew Joe博士指出,Zeno有可能成为首个针对NRG1+肺癌和胰腺癌患者的靶向疗法,并可能比目前可用的疗法有实质性的改善。
- Izalontamab
Izalontamab,又称为SI-B001,是由百利开发的一款具有First in Class潜力的EGFR/HER3双抗,能够阻断肿瘤细胞表面的EGFR与其配体EGF、HER3与其配体NRG1的结合,抑制由此引发的EGFR同源二聚体及EGFR与HER3异源二聚体的形成,从而进一步抑制了EGFR和HER3相关的信号传导通路,达到抑制肿瘤细胞的增殖、存活和转移,进而杀灭肿瘤细胞的目的。目前,该药物正在针对非小细胞肺癌、结直肠癌、食管鳞癌、头颈鳞癌等多个适应症开展6项临床研究,并在多个2期临床试验中表现了具备突破性疗效的有效性和良好的耐受性。其中非小细胞肺癌适应症的临床研究已进入3期,有望于2024-2025年在国内获批上市。此外,SI-B001联合多西他赛的临床也已获得FDA批准。
3.3 HER3单克隆抗体
不完全统计,目前全球靶向HER3的单克隆抗体共计有24款,其中有6款处于临床前阶段,处于临床阶段的有4款,其余的为无进展和终止状态。
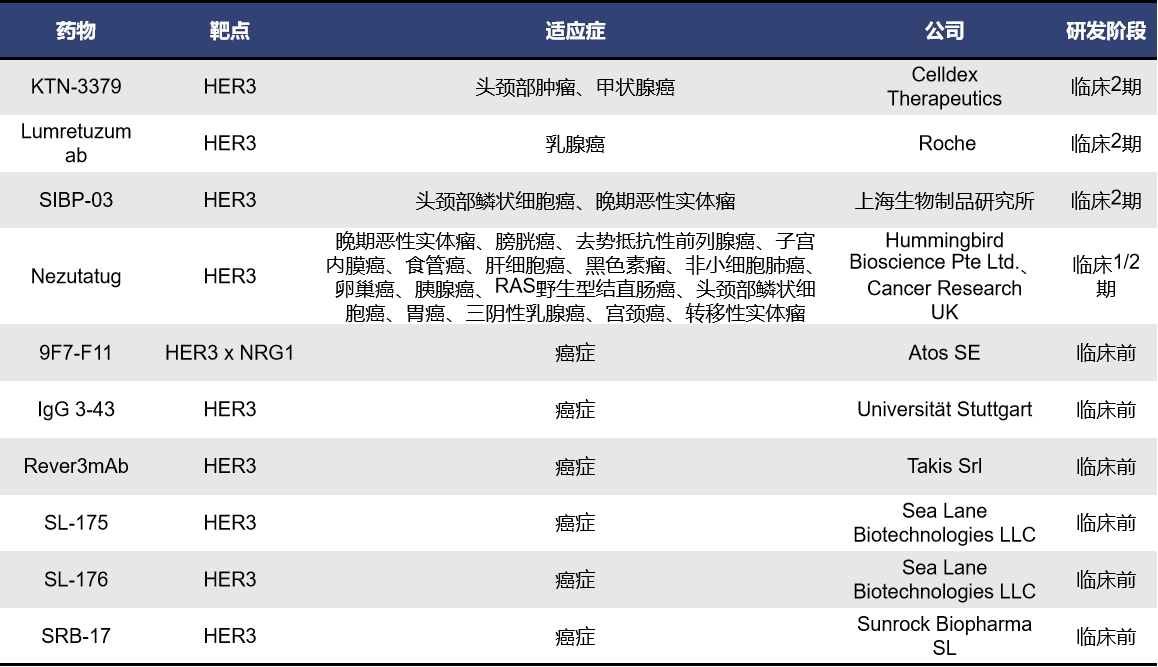
- KTN-3379
KTN-3379,也称为CDX-3379,是由Celldex Therapeutics开发的人源IgG1λ单抗,可与HER3结构域Ⅱ和Ⅲ之间边界的独特表位具有非常高的亲和力。KTN-3379与该表位结合后,可将HER3锁定在其非活性构象中,从而抑制配体依赖性和配体非依赖性的HER3活化。临床前研究表明,CDX-3379联合西妥昔单抗或BYL719(一种PI3Kα选择性抑制剂)可增强HNSCC异种移植模型的生长抑制。目前最高的研发阶段为临床2期。
- Lumretuzumab
Lumretuzumab,也称为RG7116,是由罗氏开发的糖工程人源化IgG1单抗,可与HER3的结构域Ⅰ以高亲和力特异性结合,lumretuzumab通过阻止配体heregulin与HER3结合来抑制HER3异二聚体化和磷酸化,从而抑制基于细胞系的小鼠模型中肿瘤的生长。目前最高的研发阶段为临床2期。SIBP-03是由上海生物制品研究所自主研发的一款靶向HER3 IgG1单抗,是国内首款获得临床批件的抗HER3抗体药物。目前最高的研发阶段也为临床2期。
靶向HER3的药物除了以上几种生物药类型,还有小分子化药、融合蛋白、疫苗和CAR-T疗法等。小分子化药以阿斯利康开发的AZD-8931临床进展最快,目前处于临床2期;疫苗药物均处于临床前,布局药企包括Imugene和Harvard Medical School;融合蛋白以深圳信立泰的SAL-007临床进展最快,目前处于临床2期。
4、缔码HER3相关产品与服务助力HER3生物疗法开发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供HER3靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务包括多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速HER3生物疗法的开发,缔码还制备了HER3靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们目前已筛选出有22个HER3先导分子,其中有18个验证了人猴蛋白交叉反应,客户第二天可以拿到分子进行功能评估验证;针对部分分子,我们也正在进行ADC内吞活性及杀伤验证,具体数据欢迎垂询。
- HER3蛋白&抗体&细胞株&CDX切片
- 缔码HER3先导抗体分子研究进展

参考文献:
[1] Maennling AE, Tur MK, Niebert M, et al. Molecular Targeting Therapy against EGFR Family in Breast Cancer: Progress and Future Potentials. Cancers (Basel). 2019;11(12).
[2] Esparís-Ogando A, Montero JC, Arribas J, et al. Targeting the EGF/HER Ligand-Receptor System in Cancer. Curr Pharm Des. 2016;22(39):5887–98.
[3] Kraus MH, Issing W, Miki T, et al. Isolation and characterization of ERBB3, a third member of the ERBB/epidermal growth factor receptor family: evidence for overexpression in a subset of human mammary tumors. Proc Natl Acad Sci U S A. 1989;86(23):9193–7.
[4] Cho HS, Leahy DJ. Structure of the extracellular region of HER3 reveals an interdomain tether. Science. 2002, 297 (5585): 1330–1333.
[5] Roskoski R. The ErbB/HER family of protein-tyrosine kinases and cancer. Pharmacological Research. 2014, 79: 34–74.
[6] Gandullo-Sánchez, L., Ocaña, A. & Pandiella, A. HER3 in cancer: from the bench to the bedside. J Exp Clin Cancer Res. 2020, 41, 310.
[7] Linggi B, Carpenter G. ErbB receptors: new insights on mechanisms and biology. Trends Cell Biol. 2006;16(12):649–56.
[8] Zhang X, Gureasko J, Shen K, et al. An allosteric mechanism for activation of the kinase domain of epidermal growth factor receptor. Cell. 2006;125(6):1137–49.
[9] Shi F, Telesco SE, Liu Y, et al. ErbB3/HER3 intracellular domain is competent to bind ATP and catalyze autophosphorylation. Proceedings of the National Academy of Sciences of the United States of America. 2010, 107 (17): 7692–7697.
[10] Gaborit N, Lindzen M, Yarden Y. Emerging anti-cancer antibodies and combination therapies targeting HER3/ERBB3. Human Vaccines & Immunotherapeutics. 2016 Mar;12(3):576-592.