2023年12月7日, AbelZeta宣布与阿斯利康达成协议,共同开发 C-CAR031,一种针对肝细胞癌 (HCC)的靶向Glypican-3 (GPC3)嵌合抗原受体T细胞(CAR-T)疗法。根据协议条款,AbelZeta将从阿斯利康获得预付款,用于C-CAR031在中国的共同开发和商业化。AbelZeta还有资格获得其全球开发的里程碑付款和特许权使用费。该药物由阿斯利康在中国境外独家开发、制造和商业化。那GPC3为何会受药企大佬阿斯利康的青睐呢?目前国内外又有哪些药企布局了靶向GPC3的免疫疗法?
1、GPC3蛋白结构和表达特性
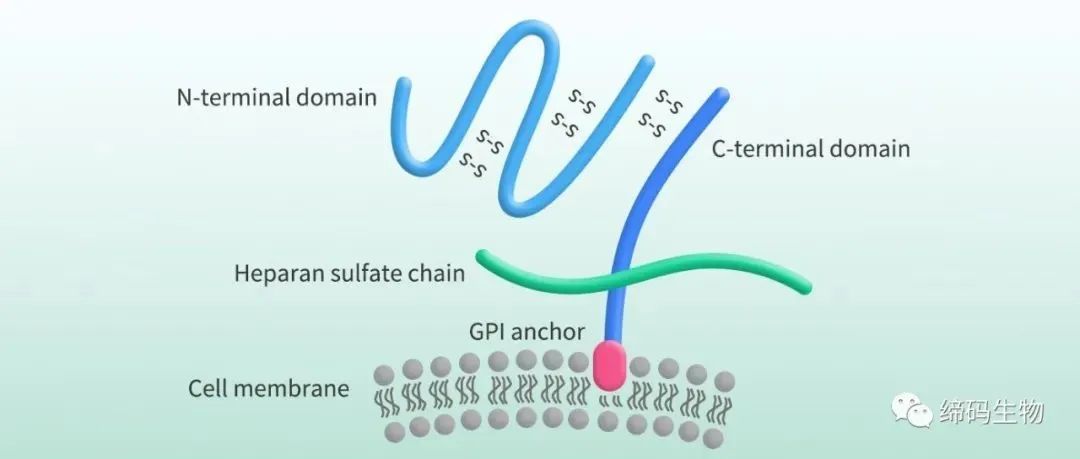
GPC3,又名DGSX、GTR2-2、MXR7、OCI-5,是由GPC3基因编码的硫酸乙酰肝素 (HS)蛋白聚糖家族的成员。GPC3基因位于染色体Xq26上,其编码的蛋白包含一个580个氨基酸的核心蛋白和两条位于C-端的HS链。GPC3核心蛋白通过糖基磷脂酰肌醇(GPI)锚连在细胞膜表面上,可被切割成大约40KDa的N端可溶性蛋白(sGPC3)和30KDa C端膜蛋白。切割后的sGPC3可以从癌细胞释放到循环中(Figure 1)。
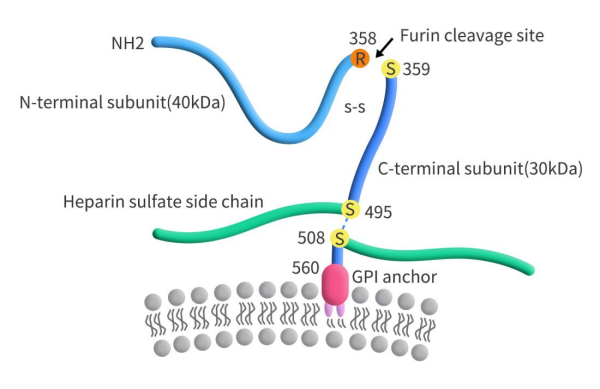
Figure 1. The structure of GPC3 [1]
GPC3在人类胚胎中广泛表达,并通过涉及胰岛素样生长因子、骨形态发生蛋白(BMP)、成纤维细胞生长因子(FGF)或刺猬蛋白(Hh)信号通路的机制在形态发生和生长中发挥重要作用 [2] [3]。GPC3可在胚胎18至30周的胎儿肝脏中检测到,但在任何正常成人肝组织,甚至脂肪肝,肝硬化,肝炎,或肝损伤等肝脏病理组织中均很少看到GPC3蛋白的表达[4] [5]。关于这一表达特性最早是由Hsu等人在1997年的研究中报道出来的,研究表明大多数HCC中GPC3的mRNA和蛋白水平比正常肝癌、胆管癌和肝癌转移的程度更高 [6]。而这一表达特性让GPC3被视为理想的肝细胞癌(HCC)诊断和治疗靶点。
2、GPC3与肝细胞癌
GPC3除了作为HCC诊断标志,还在HCC的疾病进展中发挥重要作用。有研究表明,GPC3可以通过其HS侧链结合Wnt和FGF等信号蛋白或生长因子来参与并促进HCC生长和侵袭。GPC3蛋白在肝细胞癌中的作用机制并不确定。有研究表明GPC3是通过经典 Wnt/β-catenin 信号途径发挥作用,激活Wnt信号途径使Wnt基因高表达, 从而促进肿瘤的生长。

Figure 2. The diagram of possible GPC3-mediated signaling pathway in HCC progression [7]
3、针对GPC3靶点的治疗策略
GPC3靶向药物的研究历程并不顺利。单一的GPC3单克隆抗体的临床效果不佳,与对照组相比在患者的总生存期和无进展生存期上均没有显著差异。目前临床上针对GPC3的药物研发主要集中在临床I期,涉及的药物类型包括抗体药物和细胞治疗,其中以CAR-T疗法的临床试验数最多。
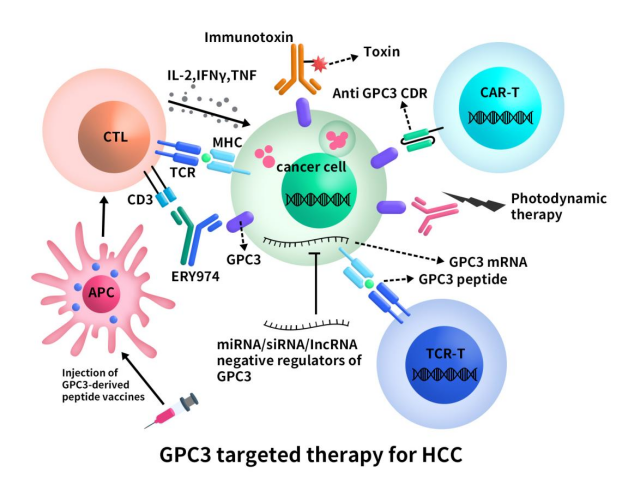
Figure 3. the diagram of GPC3 targeted therapy for HCC [8]
3.1 抗体药
- Codrituzumab(单抗)
Codrituzumab,又称为GC33,RO5137382,是由中外制药开发的一款靶向GPC3的人源化单克隆抗体。GC33是首个针对GPC3开发的人源化重组单克隆抗体,在2016年发表的2期临床试验(NCT01507168)结果中显示,在肝细胞癌(HCC)二线患者中,Codrituzumab单独使用时临床效果并不理想。2021年6月,中外制药重新启动了关于codrituzumab的I期试验(NCT04928677),继续挖掘其在实体瘤中的临床价值,目前该项临床试验仍处在招募状态。
- ERY974(双抗)
ERY974,又称为ERY101EG,是中外制药在GPC3单抗的基础上衍生出的一款GPC3/CD3双特异性抗体。ERY974抗体可以识别GPC3和CD3双抗原,在T细胞和肿瘤细胞之间构成了免疫突触,介导T细胞杀伤GPC3过表达的肿瘤细胞。目前,针对ERY974有一项新的I期临床研究(NCT05022927),用于评估对晚期肝细胞癌患者实施ERY974, Tocilicumab (IL-6R), Atezolizumab (PD-L1), 和 Bevacizumab (VEGF-A) 联合用药的安全耐受性和初步疗效。2022年9月Sano, Y等人在Nature Communications杂志发表了ERY974与化药联合用药的结果 [9],结果显示ERY974和化疗结合起来可以更有效地提高ERY974在非发炎肿瘤中的疗效,进一步验证了ERY974的联合治疗策略的研发方向。
- CM350(双抗)
CM350是基于康诺亚专有nTCE双特异性抗体平台开发的一款GPC3xCD3双特异性抗体。CM350通过同时靶向肿瘤细胞的GPC3及T细胞的CD3,激活T细胞并将其重定向至靶向肿瘤细胞,从而完成肿瘤细胞的清除,目前针对的适应症为实体瘤,尤其是肝细胞癌。CM350 现处于Ⅰ期临床的剂量递增阶段。
3.2 CAR-T疗法
- BOXR1030
BOXR1030是由SOTIOBiotech基于专有的BOXR™平台,用于治疗表达GPC3的各种实体瘤。BOXR1030的结构如下图所示,它是一款人源化GPC3靶向scFv、4-1BB共刺激域和CD3ζ信号域的二代CAR。同时,利用P2A序列连接密码子优化的GOT2,旨在评估T细胞代谢对CAR-T细胞功能的影响,而后再通过γ逆转录病毒转导生成CAR-T细胞。临床前研究表明,与传统的GPC3 CAR-T细胞相比,在缺氧和低葡萄糖条件下,BOXR1030 T细胞增殖得到改善,而且具有更好的肿瘤杀伤能力;此外,在动物分离出的肿瘤浸润淋巴细胞中,与对照细胞相比,BOXR1030对功能障碍的抵抗力更强,并且衰竭的标志物更少。BOXR1030的初始适应症包括肝细胞癌、肺鳞状细胞癌和粘液样/圆形细胞脂肪肉瘤,目前已进入临床,正在进行1/2期DUET-01临床试验(NCT05120271),该项临床试验正处于招募状态。

Figure 4. The structure of BOXR1030
- CT011&CT0180&CT0181
CT011&CT0180&CT0181均是由科济药业开发的GPC3 CAR-T产品,针对的适应症都是肝细胞癌(HCC),区别在于CAR的设计。
CT011是一种用于治疗HCC的自体GPC3细胞候选产品。CT011曾于2019年获得国家药监局的IND批准,用于治疗GPC3阳性实体瘤患者,这是中国首个针对实体瘤的CAR-T细胞疗法的IND,科济药业已在中国完成了这项的I期临床试验的患者入组(NCT03884751)。2024年1月15日,中国药品监督管理局又批准了该疗法用于治疗手术切除后出现复发风险的GPC3阳性的IIIa期肝细胞癌患者的IND申请。
CT0180是一种表达靶向GPC3抗体及T细胞受体融合蛋白的自体T细胞产品。临床前研究表明,在小鼠异种移植模型中,CT0180可有效识别和杀死GPC3阳性肝细胞癌细胞并大幅抑制HCC肿瘤生长。目前正处于一项开放标签、剂量递增的I期临床试验(NCT04756648),旨在评估CT0180在GPC3阳性的晚期HCC患者中的安全性、初步疗效和细胞药代动力学。该试验正处于招募状态。
CT0181是一种表达靶向GPC3抗体与T细胞受体融合蛋白及共表达IL-7细胞因子的自体T细胞产品。临床前研究表明,与GPC3 CAR-T细胞相比,CT0181在具有低细胞因子释放的实体瘤异种移植物中显示出卓越的抗肿瘤功效、T细胞持久性及免疫记忆。目前一项I期临床试验(NCT04973098)已经在中国启动,旨在评估CT0181治疗肝细胞癌的安全性和疗效。
- B010-A
B010-A是由上海医药研发的一款GPC3靶向CAR-T疗法。与传统CAR-T疗法相比,B010-A中新增了SPH-Engine结构,可促进CAR-T杀伤活性,同时可以促进CAR-T细胞体内循环,用于晚期实体瘤的治疗。临床前研究表明,B010-A具有更优的体内外抗肿瘤活性和更好的安全性。目前有一项早期I期临床试验(NCT05070156)已在中国启动。这是一项开放标签、单组研究,旨在观察B010-A治疗晚期肝细胞癌的安全性和耐受性。
- TAK-102
TAK-102,又称为NIB102,是武田与Noile-Immune Biotech联合开发的一款GPC3靶向CAR-T疗法。该CAR-T产品是一种表达靶向GPC3抗体及IL-7和CCL19融合蛋白的自体T细胞产品。这种新型 CAR -T 疗法的设计不仅引起GPC3靶向CAR T细胞介导的直接细胞毒性,还可以通过IL-7和CCL19的表达为CAR- T细胞提供装甲效应。在SITC-2022年会上公布的中期临床数据显示:截至2022年3月25日,接受TAK-102治疗的4例患者中均未出现剂量限制性毒性、细胞因子释放综合征或神经毒性。2例达到病情稳定(SD),并伴随肿瘤标志物如AFP、LDH的变化。在较低剂量水平下,TAK-102表现出良好的细胞动力学行为,且存在剂量效应。剂量递增研究还在进行中(NCT04405778)。
- Ori-C101
Ori-C101是由原启生物开发的一款靶向GPC3嵌合抗原受体自体T细胞。Ori-C101具有高特异性和高亲和力的靶向GPC3全人源抗体序列,能够准确地识别肝癌细胞表面的GPC3抗原。与传统的CAR-T疗法相比,Ori-C101有独特的信号激活元件Ori,这个元件可以成倍提升记忆性免疫细胞的扩增效率,从而增强CAR-T细胞的抗肿瘤活性和持久性。在2021年美国临床肿瘤学会(ASCO)年会上公布的数据中,Ori-C101在GPC3阳性晚期肝癌患者中表现出卓越的安全性和有效性,客观缓解率(ORR)为44%,疾病控制率(DCR) 为 78%。迄今为止最长的随访时间超过22个月,更多的随访正在进行中。目前,Ori-C101仍有一项P期临床试验(NCT05652920)正在进行中,这是一项I期、开放标签、多中心研究,旨在评估Ori-C101治疗晚期肝细胞癌(HCC)的安全性、药代动力学和初步疗效。
- TC-CAR-031
TC-CAR-031,又称为C-CAR031,是由阿斯利康设计、针对HCC的自体抗GPC3装甲型CAR-T疗法。如下图所示,C-CAR031包括GPC3 CAR、T2A肽和装甲型显性负性TGF-βII型受体(TGFβRIIDN)。GPC3 CAR中包含表达靶向GPC3抗体、表达4-1BB和CD3z融合蛋白的细胞内结构域;TGFβRIIDN的表达可以保护细胞抵抗免疫抑制性肿瘤微环境;而T2A肽允许等量表达两种转基因产物。

Figure 5. The structure of C-CAR031
12月7日,AbelZeta宣布与阿斯利康(AstraZeneca)就C-CAR031签署联合开发协议。在2023 AACR年年会上,AbelZeta公布了一项在中国开展的研究者发起的临床试验(NCT05155189)。这是该疗法的首次人体试验,旨在研究C-CAR031治疗HCC患者的可行性、安全性和初步疗效,目前该研究正处于入组状态。初步展示了C-CAR031的安全性、有效性、药代动力学(PK)和药效动力学(PD)数据。数据显示,C-CAR031在晚期肝细胞癌患者中具有良好的抗肿瘤活性和稳健的PK/PD特征。
- 更多GPC3 CAR-T疗法
| 药品名称 | 企业名称 | 研发阶段 | 适应症 | 临床试验代码 |
| JWATM214001 | 药明巨诺 | NA | 肝细胞癌 | NCT05926726/NCT06144385 |
| ECT204 | 优瑞科生物 | 1期临床 | 肝细胞癌 | NCT04864054 |
| CG1003 | 科济药业 | 1期临床 | 肺鳞细胞癌 | NCT02876978/NCT02395250 |
| GB5011 | 吉凯基因 | 1/II期临床 | 肝细胞癌 | NCT02715362/NCT03130712 |
| GLYCAR T cell therapy (Baylor College of Medicine) | 贝勒医学院 | 1期临床 | 肝细胞癌 | NCT04377932 |
| Anti-GPC3 CAR T-cell therapy | 南京大学 | 1期临床 | 肝细胞癌 | NCT04121273 |
| Anti-GPC3 chimeric antigen receptor T cell therapy | 湖南昭泰涌仁, 广东昭泰体内生物 | 1期临床 | 鳞状细胞癌,肝细胞癌 | NCT03198546 |
4、缔码GPC3 CAR-T 细胞制备及测试
缔码生物拥有自己独立开发的CAR-T先导分子筛选实验平台。过去两年,我们已成功完成了200多个项目的抗体先导分子开发工作,部分CAR-T先导分子已经完成临床前实验阶段。针对GPC3靶点,缔码已成功完成多个抗体分子的CAR-T细胞制备及24小时短效杀伤测试。欢迎咨询测试。
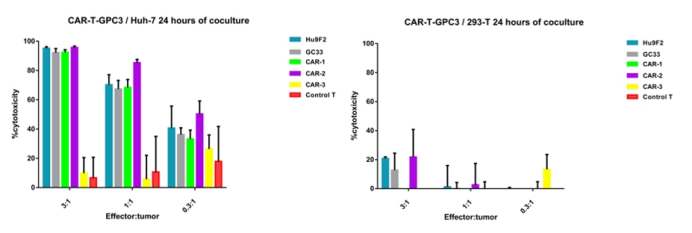
Figure 6. The data of CAR-T-GPC3/Huh-7 (Left) or 293-T (Right) 24 hours of co-culture
此外,为助力靶向GPC3生物药研发,缔码还相应开发了GPC3靶点全系列产品与,产品包括功能活性蛋白、流式验证抗体及参照抗体;服务涉及抗体人源化和亲和力成熟。此外,为了加速GPC3靶向药物研发,缔码还制备了GPC3靶点的B细胞种子库,最快20天可获得GPC3抗体先导分子。
| 产品类型 | 名称 | 货号 | 验证 |
| 活性蛋白 | Human GPC3 Protein, hFc Tag | PME100113 | SDS-PAGE, ELISA |
| FC验证单抗 | Anti-GPC3 antibody(DMC371); IgG1 Chimeric mAb | DMC100371 | FC |
| IHC验证单抗 | Anti-GPC3 antibody(163D11), IgG1 Chimeric mAb | DMC100908 | IHC |
| 参照抗体 | Anti-GPC3(Hu9F2) mAb | BME100147 | ELISA |
| 参照抗体 | Anti-GPC3(codrituzumab biosimilar) mAb | BME100083 | ELISA, FC |
| 生物素标记抗体 | Biotinylated Anti-GPC3 antibody(DMC371); IgG1 Chimeric mAb | DMC100371B | / |
| 生物素标记抗体 | Biotinylated Anti-GPC3 antibody(163D11), IgG1 Chimeric mAb | DMC100908B | / |
| 生物素标记抗体 | Biotinylated Anti-GPC3(codrituzumab biosimilar) mAb | BME100083B | / |
| 生物素标记抗体 | Biotinylated Anti-GPC3(Hu9F2) mAb | BME100147B | / |
参考文献:
[1]Ho, Mitchell, and Hungnam Kim. “Glypican-3: a new target for cancer immunotherapy.” European journal of cancer 47.3 (2011): 333- 338.
[2]Filmus J, Capurro M, Rast J. Glypicans. Genome Biol. 2008;9(5):224.
[3]Traister A, Shi W, Filmus J. Mammalian Notum induces the release of glypicans and other GPI anchored proteins from the cell surface. Biochem J. 2008;410(3):503–511.
[4]Yamauchi N, Watanabe A, Hishinuma M, et al. The glypican 3 oncofetal protein is a promising diagnostic marker for hepatocellular carcinoma. Mod Pathol. 2005;18(12):1591–1598.
[5]Zhang L, Liu H, Sun L, Li N, Ding H, Zheng J. Glypican-3 as a potential differential diagnosis marker for hepatocellular carcinoma: a tissue microarray-based study. Acta Histochem. 2012;114(6):547–552.
[6]Hsu HC, Cheng W, Lai PL. Cloning and expression of a developmentally regulated transcript MXR7 in hepatocellular carcinoma: biological significance and temporospatial distribution. Cancer Res. 1997;57(22):5179–5184.
[7]Wu Y, Liu H, Ding H. GPC-3 in hepatocellular carcinoma: current perspectives. J Hepatocell Carcinoma. 2016 Nov 8;3:63-67.
[8]Zheng, Xiufeng et al. “Glypican-3: A Novel and Promising Target for the Treatment of Hepatocellular Carcinoma.” Front Oncol. 2022 Feb 16.
[9]Sano, Y., Azuma, Y., Tsunenari, T. et al. Combination of T cell-redirecting bispecific antibody ERY974 and chemotherapy reciprocally enhances efficacy against non-inflamed tumours. Nat Commun 13, 5265 (2022).