目前最受欢迎的GLP1类单药疗法司美格鲁肽可通过促进胰岛素分泌来控制血糖,还能持久引发饱腹感,减少食欲。但这类药物会引起恶心和呕吐等副作用,这些副作用会影响患者治疗。 2024年7月10日,Kuei-Pin Huang等人在Nature上发表了一篇题为Dissociable hindbrain GLP1R circuits for satiety and aversion的研究,研究结果指出未来的减肥药物可以通过选择性靶向孤束核NTS的GLP1R神经元,来避免引起厌恶感,从而提高治疗的依从性和有效性[1]。今天我们就来聊聊GLP1R~
1、GLP1R结构
1992年,Thorens从大鼠胰腺β细胞分离并鉴定出第一个胰高血糖素样肽-1受体(GLP1R)cDNA [2],次年1993年克隆了人类GLP1R。GLP1R与胃抑制肽受体(GIPR)一样,属于G蛋白偶联受体(GPCR)的B1类受体家族。人源胰高血糖素样肽-1受体(hGLP1R)由位于6 号染色体上的GLP1R基因编码,大小为40kb,含14个外显子左右。人和大鼠GLP1R均含有463个氨基酸,小鼠GLP1R为489个氨基酸,与hGLP-1R同源性分别为91%和84%。
与所有B类GPCR一样,GLP1R具有100-150个残基的N端ECD,连接到一个完整的7TM结构域,这是所有GPCR的典型特征,具有七个α螺旋 (TM1-TM7),由三个细胞内环(ICL1-ICL3)和三个细胞外环(ECL1-ECL3)隔开,另外还有一个胞内C端结构域。GLP1R蛋白N端ECD结构域可形成三层α-β-βα折叠,由三对半胱氨酸二硫键稳定。N端ECD可结合胰高血糖素样肽-1(GLP-1)的C端螺旋,包含参与配体识别和结合的关键区域。与配体结合后,N端会发生构象变化,从而激活细胞内信号转导级联。跨膜结构域(TMD)可结合GLP-1的N端区域,而且在TMD结构域中,有一个极性残基的支点,可调节受体的偏向信号传导。胞内C端与胞内信号蛋白相互作用,启动下游信号通路[4]。
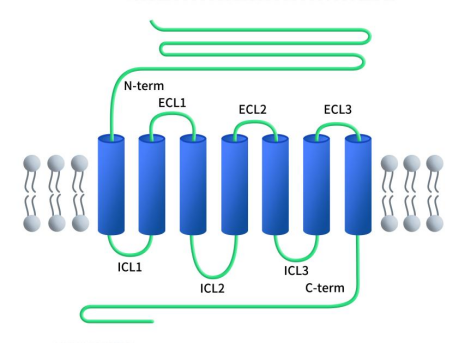
Figure 1. The structure of GLP1R [4]
2、GLP1R分布与功能
GLP-1R 广泛分布在胰腺、胃、十二指肠、肺、心脏、肾脏和脑等许多组织和器官中,但主要是在胰岛β细胞中表达,脑中GLP-1r 密度最高的是孤束核、后区、脚间核、后背核和腹侧被盖核、下丘脑核、丘脑核、伏隔核和侧隔[5]。
GLP1R可通过与GLP1及其类似物结合激活后发挥生物学功能。在胰岛β细胞中,GLP-1R的主要作用是促进胰岛β细胞的增殖,刺激胰岛素的合成与分泌,并抑制胰高血糖素的合成与释放。在胃肠道等组织中,GLP-1R可以抑制胃酸分泌和胃肠道的蠕动,延迟胃的排空,增加饱食感,减少食物摄取。在神经组织中,GLP-1R信号影响中枢神经系统,特别是参与食欲调节的区域。GLP-1R的激活会促进饱腹感,从而减少食物摄入量并改善体重管理。在心血管方面,GLP-1R可以提升心血管的功能,减少炎症[6]。
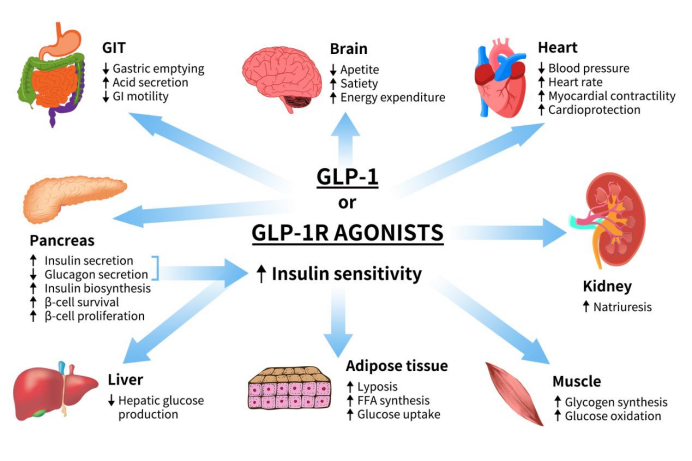
Figure 2. The role of GLP1 or GLP1R agonists [6]
3、GLP1R信号作用机制
如前所述,GLP1R主要通过与其配体GLP1及其类似物结合激活后发挥生物学功能,这里重点介绍GLP1R在胰腺中的信号作用机制。在胰腺中,目前认为GLP-1R主要通过Gαs /cAMP 通路发出信号,但有证据表明GLP-1R也与Gαq和其他G蛋白偶联。GLP-1R激活后,C末端发生磷酸化,进一步募集β-arrestin,导致受体内化和脱敏。Gαs/cAMP通路可直接引发葡萄糖诱导的胰岛素颗粒分泌。GLP-1R完全激活后,会与Gαs进行偶联并激活腺苷酸环化酶(AC),使ATP转化为环磷酸腺苷(cAMP),从而增加cAMP的浓度。cAMP水平升高会进一步激活蛋白激酶A(PKA)和Rap鸟嘌呤核苷酸交换因子4(RAPGEF4,又称EPAC2)。激活的PKA和EPAC2可以关闭ATP依赖性的K +通道和电压依赖性的K +通道,使细胞膜去极化,同时激活电压依赖性钙通道(VDCC),引起Ca2+内流。除了cAMP的经典功能外,cAMP/CREB通路还能诱导胰岛素受体底物2 (IRS2) 表达并促进β细胞存活,这也进一步证明了GLP-1类似物对β细胞的保护作用 [7] [8] [9] [10]。
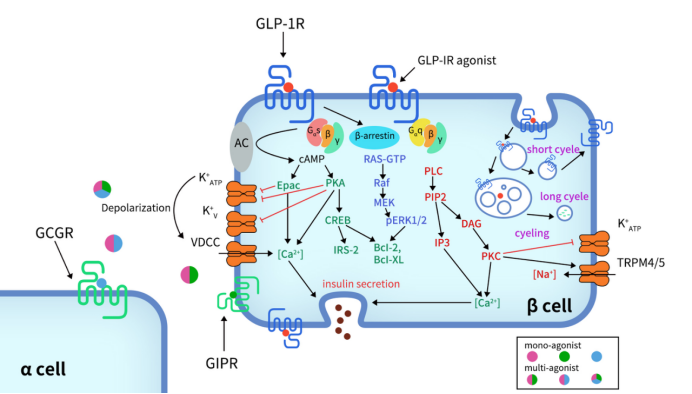
Figure 3. Signaling pathways of GLP-1R in pancreatic β-cell [11]
除了Gαs /cAMP信号通路,GLP-1R也能偶联其他G蛋白亚型,比如Gαi、 Gαq、 Gαo、 和Gα11。最近的研究表明Gαq通路在胰腺β细胞中具有重要作用。首先,Gαq通路从磷脂酶 C (PLC)的偶联开始,将磷脂酰肌醇4,5-二磷酸 (PIP2) 转化为肌醇三磷酸3 (IP3)和二酰甘油 (DAG),并伴随蛋白激酶C (PKC)的激活和通过IP3受体产生细胞内Ca2+ 内流。PKC 还触发ATP依赖性K+通道的关闭和TRPM4/5的激活[40]。Gαs和Gαq分别调节cAMP和 Ca2+水平 [12] [13]。然而,在复杂的G蛋白信号通路网络中存在变异机制。在某些条件下,比如细胞膜持续去极化和GLP-1浓度降低至皮摩尔,Gαs和Gαq通路会发生切换 [14]。G蛋白通路的转换阐明了药物治疗下基础胰岛素分泌的可能机制,为2型糖尿病的肠促胰岛素治疗提供了重要方向。
4、GLP1R临床药物研究进展
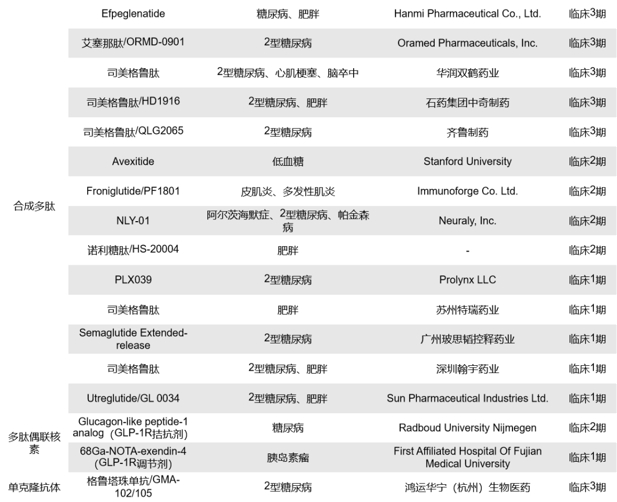
不完全统计,目前全球关于GLP1R临床药物共有413款,其中临床前的有近110款,处于临床阶段和已上市的共计有154款。在这154款中,GLP1R单靶点的药物有96款,双靶点GIPR x GLP1R、GCGR x GLP1R、INSR x GLP1R、FGF21R x GLP1R、GLP-2Rx GLP1R和FGF21 x GLP1R分别有19、16、7、3、2和1款。药物类型包括合成多肽、重组蛋白、小分子化药、生物类似物和融合蛋白等。这里重点展示GLP1R单靶点的药物。更多关于双靶点GIPR x GLP1R药物临床研究进展>>
- 已获批上市药物
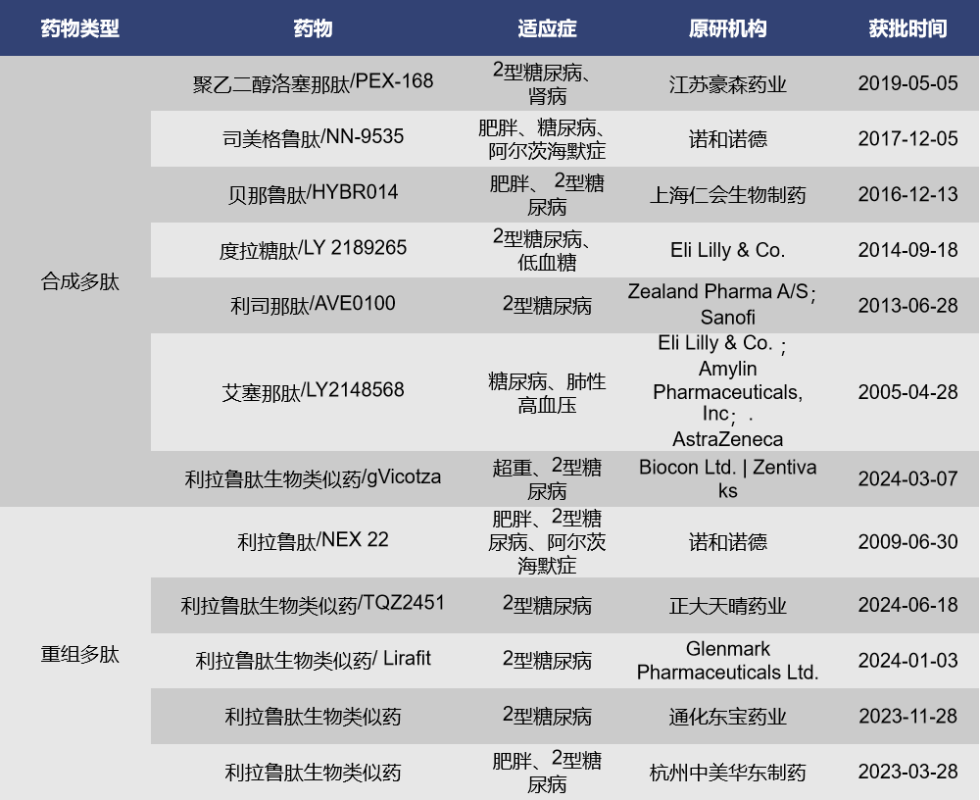
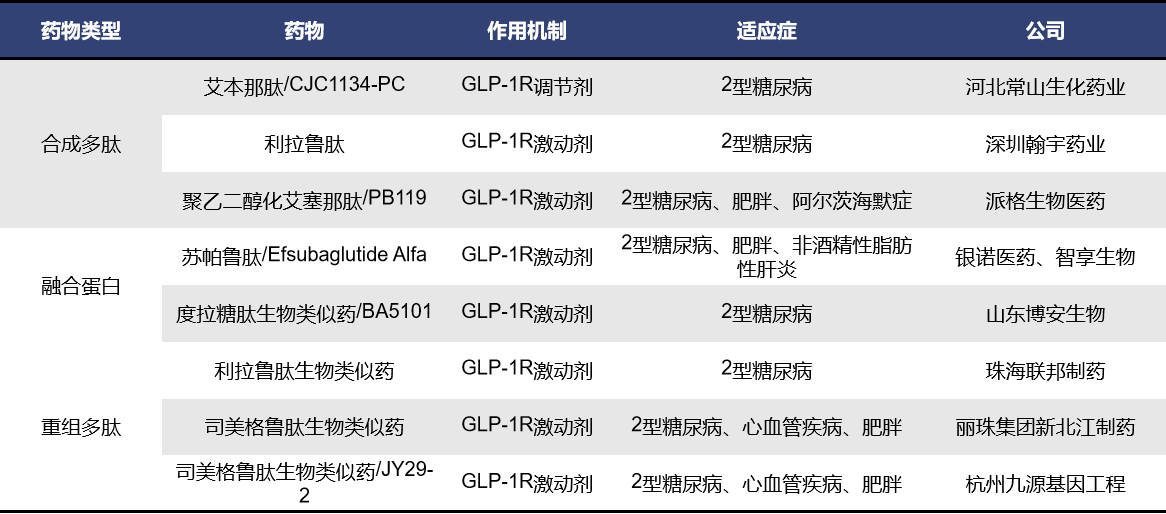
目前,靶向GLP1R单靶点药物获批上市的共计12款,7款为合成多肽,5款为重组多肽,均为GLP1R激动剂。其中,最早获批上市的是礼来的艾塞那肽,于2005年4月上市,曾获欧盟的孤儿药认证;随后获批的是诺和诺德的利拉鲁肽,2009年6月上市,这款药也是目前全球累计销售额最高的GLP-1受体激动剂,而且,2023年到2024年间,共有相继有5款款利拉鲁肽生物类似药获批上市;Zealand Pharma的利司那肽是2013年6月获批上市,针对的适应症为2型糖尿病;2014年9月,礼来的度拉糖肽获批上市并获得中国的优先评审资格;现在火爆全球的减肥药司美格鲁肽是由诺和诺德研发,与2017年12月上市,在中国获得了突破性疗法认证,该药2024年上半年的销售额在2024年上半年全球畅销药中排名第二,仅次于默沙东的Keytruda。
利拉鲁肽和司美格鲁肽都是诺和诺德开发的GLP1R单靶点激动剂。GLP1R激动剂的产生主要是为了解决天然GLP-1半衰期短的问题。利拉鲁肽和司美格鲁肽都可以抑制摄食中枢,抑制人的食欲,让人不想吃东西,同时还能延缓胃排空,增强饱腹感,让人感觉不到饿,从而让人进食减少。二者都是皮下注射,不同的是利拉鲁肽是长效激动剂,而司美格鲁肽是超长效激动剂, 利拉鲁肽是一天打一次,司美格鲁肽是每周打一次。
- 正在申请上市的药物
目前处于上市申请阶段的GLP1R单靶点药物共有8款,包含合成多肽、融合蛋白和重组多肽三种药物类型,其中7款为GLP-1R激动剂,有3款为司美格鲁肽生物类似药。
- 临床阶段药物
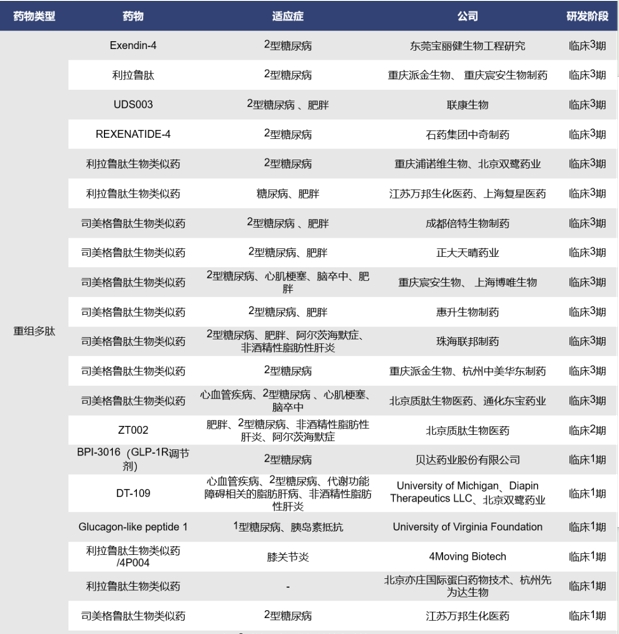
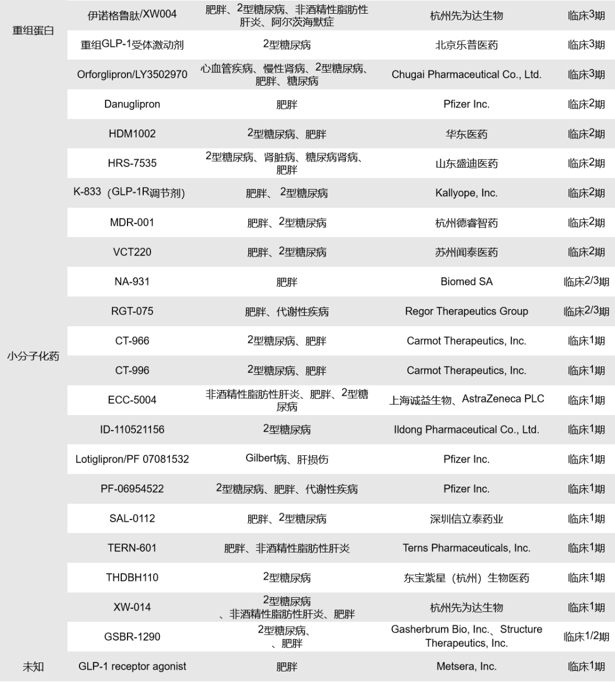
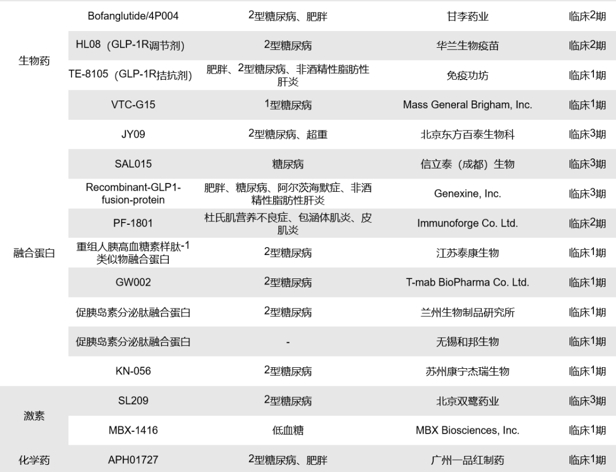
全球目前处于临床1、2、3期的单靶点GLP-1R药物共有76款,其中处于临床3期的有26款、2/3期的有2款、2期的有15款、1/2期的有1款、1期的有32款,涉及的药物类型包括合成多肽、小分子化药、重组多肽和融合蛋白等,其中多数药物以小分子化药和重组多肽为主。
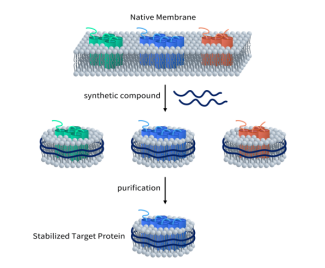
5、缔码全长活性GLP1R蛋白,助力GLP1R新药研发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码生物利用自主研发的Synthetic Nanodisc膜蛋白表达技术平台已开发出全长的人GLP1R蛋白。与市面上大多数MSP(膜支持蛋白)Nanodisc不同,缔码生物研发的Synthetic Nanodisc是基于真核表达系统,能直接从完整的细胞中制作。在这个过程中,使用的合成高分子具有双重功能。首先,它溶解细胞膜,类似于洗涤剂,然后利用天然细胞磷脂在膜蛋白周围形成纳米盘结构。跨膜蛋白可整合到Nanodiscs中。更多关于Nanodisc介绍请阅读>>
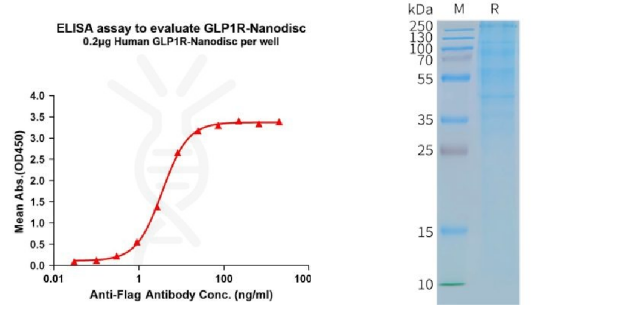
目前,缔码生物已利用Nanodiscs全长膜蛋白平台开发了数百种膜蛋白,点击这个可查看所有膜蛋白。
Human GLP1R full length protein-synthetic nanodisc (FLP100121)
此外,基于缔码生物单B细胞抗体发现、缔码功能膜蛋白开发、抗体工程改造与功能验证平台,缔码生物还可提供多种属蛋白抗体定制服务、抗体人源化亲和力成熟服务及先导分子发现服务。具体服务详情,欢迎致电垂询。
参考文献:
[1]Huang, KP., Acosta, A.A., Ghidewon, M.Y. et al. Dissociable hindbrain GLP1R circuits for satiety and aversion. Nature (2024).
[2]Thorens B (1992) Expression cloning of the pancreatic beta cell receptor for the gluco-incretin hormone glucagon-like peptide 1. Proc Natl Acad Sci USA 89:8641–8645.
[3]Graaf, C.d, Donnelly, D., Wootten, D.,et al. Glucagon-Like Peptide-1 and Its Class B G Protein-Coupled Receptors: A Long March to Therapeutic Successes. Pharmacological reviews, 2016, 68(4), 954–1013.
[4]Donnelly D. The structure and function of the glucagon-like peptide-1 receptor and its ligands. British journal of pharmacology, 2012, 166(1), 27–41.
[5]Smith, N. K., Hackett, T. A., Galli, A., et al. GLP-1: Molecular mechanisms and outcomes of a complex signaling system. Neurochemistry international, 2019, 128, 94–105.
[6]Saraiva, F.K., Sposito, A.C. Cardiovascular effects of Glucagon-like peptide 1 (GLP-1) receptor agonists. Cardiovasc Diabetol, 2014, 13, 142.
[7]Marzook, A.; Tomas, A.; Jones, B. The Interplay of Glucagon-Like Peptide-1 Receptor Trafficking and Signalling in Pancreatic Beta Cells. Front. Endocrinol. 2021, 12, 678055.
[8]Kuna, R.S.; Girada, S.B.; Asalla, S., et al. Glucagon-like peptide-1 receptor-mediated endosomal cAMP generation promotes glucose-stimulated insulin secretion in pancreatic beta-cells. Am. J. Physiol. Endocrinol. Metab. 2013, 305, E161–E170.
[9]Lee, Y.S.; Jun, H.S. Anti-diabetic actions of glucagon-like peptide-1 on pancreatic beta-cells. Metabolism 2014, 63, 9–19.
[10]Rorsman, P.; Braun, M. Regulation of insulin secretion in human pancreatic islets. Annu. Rev. Physiol. 2013, 75, 155–179.
[11]Wan, W.; Qin, Q.; Xie, L.; et al. GLP-1R Signaling and Functional Molecules in Incretin Therapy. Molecules 2023, 28, 751.
[12]Bavec, A.; Hallbrink, M.; Langel, U.; et al. Different role of intracellular loops of glucagon-like peptide-1 receptor in G-protein coupling. Regul. Pept. 2003, 111, 137–144.
[13]Shigeto, M.; Ramracheya, R.; Tarasov, A.I.; et al. GLP-1 stimulates insulin secretion by PKC-dependent TRPM4 and TRPM5 activation. J. Clin. Investig. 2015, 125, 4714–4728.
[14]Shigeto, M.; Cha, C.Y.; Rorsman, P.; et al. A role of PLC/PKC-dependent pathway in GLP-1-stimulated insulin secretion. J. Mol. Med. 2017, 95, 361–368.
