2024年2月27日,Viking Therapeutics公布GLP-1R/GIPR双靶点激动剂VK2735治疗肥胖临床IIa期研究结果,结果显示经过13周的治疗后,最高减重13.1%。受此消息影响,Viking股价大涨121%。Viking已收到美国FDA的书面反馈,计划将该管线推进到3期开发阶段。VK2735有可能成为礼来Mounjaro的直接竞争对手。Mounjaro是目前唯一获批的双重 GLP-1/GIP受体激动剂。今天,我们就暂且先来聊聊GIPR的相关背景及目前临床药物的竞争格局。
1、GPCR家族
胃抑制多肽(GIP)受体(GIPR)属于G蛋白偶联受体(GPCR)超家族。GPCR是人类基因组编码的最大蛋白质家族。它们位于细胞膜上,将细胞外信号转化为关键的生理效应,这类蛋白结构特性是具有七次跨膜蛋白,也正是这个特征,赋予了这个家族蛋白多样化的下游信号通路,也让它们在药物开发方面极具吸引力。人类 GPCR 家族根据其氨基酸序列分为A类(视紫红质样家族)、B类(促胰液素和粘附)、C类(谷氨酸)和F类(卷曲)亚家族 [1]。A类GPCR,由719个成员组成,可细分为几个亚类:胺能亚类、肽亚类、蛋白质亚类、脂质亚类、褪黑激素亚类、核苷酸亚类、类固醇亚类、脂肪羧酸亚类、感觉亚类和孤儿亚类。B类GPCR可进一步分为两个亚家族:促胰液素(B1)和粘附(B2),分别含有 15 个和 33 个成员。C 类共包含22个受体,进一步可分为5个亚家族:1个钙敏感受体(CaSR)、2个γ-氨基丁酸(GABA)B型受体(GABA B1和 GABA B2)、3个味觉1受体(TS1R1、TS1R2和TS1R3)、8 个代谢型谷氨酸受体(mGluR1–8)和8个孤儿GPCR。F类共包含11个成员,1个是平滑肌受体(SMO),另外10个都是卷曲受体(FZD1-10)[2]。
2、GIPR结构与分布
准确来说,GIPR属于GPCR的B1类受体家族,可与胰高血糖素样肽 (GLP) 结合。GIPR蛋白包含一个大的细胞外N端结构域,七个跨膜结构域和一个短的细胞内C端结构域。其中,N端结构域中包含六个高度保守的半胱氨酸残基,形成三个二硫键。C端胞内结构域通过与 G 蛋白的物理结合介导细胞内信号转导。GIPR在机体分布广泛,包括胰腺、胃、小肠、脂肪组织、心脏、脑组织中均有表达,其中主要存在于胰腺的β细胞中。经GIP激活的GIPR通过与异源三聚体Gs(αβγ)结合,诱导腺苷酸环化酶活化,增加细胞质中的cAMP水平,cAMP激活PKA,使调节基因转录蛋白磷酸化,并导致其移位至细胞核。
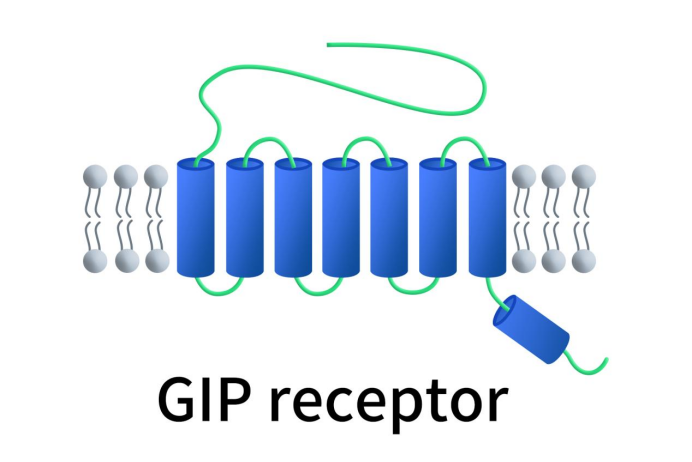
Figure 1. The structure of GIPR
3、GIP/GIPR信号通路的作用机制
GIP,又称为葡萄糖依赖性胰岛素促泌多肽,是两种肠促胰岛素激素之一,另外一种是胰高血糖素样肽 1 (GLP-1) ,可将营养摄入与全身代谢联系起来。GIP对不同系统有多种影响,主要是食物摄入后增强胰腺β细胞的胰岛素分泌(即肠促胰岛素效应)。研究发现,餐后,在血糖浓度升高时,在胰岛β细胞中,GIP会与细胞膜表面的GIPR结合,激活腺苷酸环化酶-环磷酸腺苷-蛋白激酶A(AC-cAMP-PKA)通路,使下游钙通道开放,钙离子内流增加,刺激胰岛素原基因转录增加,从而促进胰岛素分泌。在空腹或低血糖条件下,游离脂肪酸与过氧化物酶体增殖激活受体α(PPARα)结合。然后,PPARα会与类视黄酸X受体(RXR)形成异二聚体并移位至细胞核与过氧化物酶体增殖反应元件(PPRE)结合,从而刺激GIPR转录并导致细胞表面GIPR表达增加。然而,高葡萄糖通过 PPARα启动子内的响应元件 (GRE) 抑制PPARα转录。这会导致PPARα转录及表达减少。随着细胞中PPARα的减少,它不再能够完全刺激GIPR表达,继而导致GIPR表达下降。GIPR表达减少会导致β细胞响应GIP的胰岛素分泌减少 [3]。
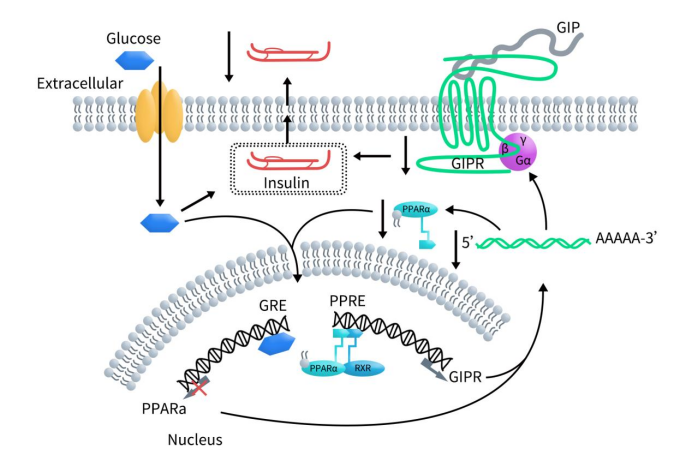
Figure 2. GIP binds to GIPR activating adenylyl cyclase, thereby potentiating glucose-induced insulin secretion [3]
此外,在血糖正常和血糖浓度降低时,GIP与胰岛α细胞上的GIPR结合,促进胰高血糖素的分泌。GIP/GIPR轴除了与代谢紊乱有关之外,如2型糖尿病餐后胰岛素分泌受损,以及肥胖和相关胰岛素抵抗的发病机制,现已有多项研究报道在几种内分泌肿瘤中存在不适当的GIP/GIPR 轴激活 [4]。
4、GIPR靶向药临床研究进展
据不完全统计,目前全球关于GIPR靶点药物共有75款,其中合成多肽有30款,小分子化药有10款,GIPRxGLP1R双靶点药物有近44款,仅靶向GIPR的只有17款。这些药物大多处于临床前期,处于临床阶段的只有28款,上市的只有1款。药物类型除了合成多肽和小分子,还有化学药、融合蛋白、双抗和重组多肽等。
- 合成多肽
目前临床上靶向GIPR的合成多肽药物共计13项,其中目前唯一一款获FDA批准上市的靶向GIPR药物-替尔泊肽也是合成多肽。处于临床3期的药物有2款,包括福建盛迪医药的HRS-9531和礼来的瑞他鲁肽,其中HRS-9531是双靶点GIPR x GLP-1R激动剂,瑞他鲁肽是三靶点GCGR x GIPR x GLP-1R激动剂;处于临床2期的有5款,包括博瑞新创的BGM-0504、罗氏的CT-388与CT-868、江苏豪森的eHS20094及Viking的VK-2735,这五款都是双靶点GIPR x GLP-1R激动剂;处于临床1期的共有5款,分别是浙江道尔的DR10627、华东医药的HDM1005、礼来的LY-3493269、东宝紫星的THDBH120和联邦生物UBT-251,其中除了UBT-251是三靶点GCGR x GIPR x GLP-1R激动剂外,其余均为双靶点GIPR x GLP-1R激动剂。针对的适应症均以肥胖和糖尿病为主。
| 药物 | 靶点 | 适应症 | 公司 | 研发阶段 |
| 替尔泊肽 | GIPR x GLP-1R | 肥胖、 2型糖尿病 、非酒精性脂肪性肝炎 | Lexaria Bioscience Corp.Eli Lilly & Co. | 批准上市 |
| HRS-9531 | GIPR x GLP-1R | 肥胖、糖尿病 | 福建盛迪医药 | 临床3期 |
| 瑞他鲁肽 | GCGR x GIPR x GLP-1R | 动脉粥样硬化、慢性肾病、2型糖尿病、 | Eli Lilly & Co. | 临床3期 |
| BGM-0504 | GIPR x GLP-1R | 肥胖、糖尿病 | 博瑞新创生物医药 | 临床2期 |
| CT-388 | GIPR x GLP-1R | 肥胖、2型糖尿病 | Carmot Therapeutics, Inc. Roche Holding AG | 临床2期 |
| CT-868 | GIPR x GLP-1R | 1型糖尿病、肥胖 | Roche Holding AG Carmot Therapeutics, Inc. | 临床2期 |
| eHS20094 | GIPR x GLP-1R | 肥胖、2型糖尿病 | 江苏豪森药业 | 临床2期 |
| VK-2735 | GIPR x GLP-1R | 肥胖、 代谢性疾病、非酒精性脂肪性肝炎 | Viking Therapeutics, Inc. | 临床2期 |
| DR10627 | GIPR x GLP-1R | 糖尿病、非酒精性脂肪性肝炎 | 浙江道尔生物 | 临床1期 |
| HDM1005 | GIPR x GLP-1R | 肥胖、糖尿病 | 华东医药股份 | 临床1期 |
| LY-3493269 | GIPR x GLP-1R | – | Eli Lilly & Co. | 临床1期 |
| THDBH120 | GIPR x GLP-1R | 肥胖、2型糖尿病 | 东宝紫星生物医药 | 临床1期 |
| UBT-251 | GCGR x GIPR x GLP-1R | 肥胖、2型糖尿病、非酒精性脂肪性肝炎 | 联邦生物科技 | 临床1期 |
- 小分子化药
目前临床上靶向GIPR的小分子化药共计6款,其中Hanmi Pharmaceutical 有两款,HM-15211和HM-15275,分别处于临床2期和临床1期,均为三靶点GCGR x GIPR x GLP-1R激动剂/调节剂;礼来有一款仅靶向GIPR的激动剂,LY-3537021,目前处于临床1期;此外,浙江和泽的HZ-012、Takeda的SCO-094和Kariya的KP-405均处于临床1期,且均为双靶点GIPR x GLP-1R激动剂。
| 药物 | 靶点 | 适应症 | 公司 | 研发阶段 |
| HM-15211 | GCGR x GIPR x GLP-1R | 非酒精性脂肪性肝炎 | Hanmi Pharmaceutical Co., Ltd. | 临床2期 |
| HM-15275 | GCGR x GIPR x GLP-1R | 肥胖 | Hanmi Pharmaceutical Co., Ltd. | 临床1期 |
| HZ-012 | GIPR x GLP-1R | 肥胖 | 浙江和泽医药 | 临床1期 |
| LY-3537021 | GIPR | – | Eli Lilly & Co. | 临床1期 |
| SCO-094 | GIPR x GLP-1R | 糖尿病、非酒精性脂肪性肝炎、肥胖 | Takeda Pharmaceutical Co., Ltd. | 临床1期 |
| KP-405 | GIPR x GLP-1R | 帕金森病 、阿尔茨海默症 | Kariya Pharmaceuticals ApS | 早期临床1期 |
- 融合蛋白&双抗
目前临床上靶向GIPR的融合蛋白有2款,分别是上海民为的MWN-101(GCGR x GIPR x GLP-1R激动剂)和Amgen的AMG-133(GIPR x GLP-1R激动剂),二者均处于临床2期。临床阶段的双抗目前仅有1款,是由鸿运华宁原研的GMA106,一款GIPR x GLP-1R激动剂,目前处于临床1期。
| 药物类型 | 药物 | 靶点 | 适应症 | 公司 | 研发阶段 |
| 融合蛋白 | MWN-101 | GCGR x GIPR x GLP-1R | 2型糖尿病 、肥胖 | 上海民为生物 | 临床2期 |
| 融合蛋白 | AMG-133 | GIPR x GLP-1R | 2型糖尿病、肥胖 | Amgen, Inc. | 临床2期 |
| 双特异性抗体 | GMA106 | GIPR x GLP-1R | 糖尿病、肺沉着症、非酒精性脂肪性肝炎、肥胖 | 鸿运华宁生物医药 中国生物制药Gmax Biopharm Australia Pty Ltd. | 临床1期 |
- 重组多肽
目前临床上靶向GIPR的重组多肽类药物共有3款,包括诺华的NNC0519-0130、礼来的LY-3532226和Gentofte的GIP[3-30]NH2。其中进展最快的是诺华的NNC0519-0130,目前处于临床2期,另外两款分别处于临床1期和早期临床1期。值得注意的是,Gentofte的GIP[3-30]NH2是目前临床上唯一一款仅作用于GIPR拮抗剂。
| 药物 | 靶点 | 适应症 | 公司 | 研发阶段 |
| NNC0519-0130 | GIPR x GLP-1R | 2型糖尿病、肥胖 | Novo Nordisk A/S | 临床2期 |
| LY-3532226 | GIPR | 糖尿病、 低血糖 | Eli Lilly & Co. | 临床1期 |
| GIP[3-30]NH2 | GIPR | 肥胖 | Gentofte Hospital | 早期临床1期 |
- 其他药物类型
此外,处于临床阶段靶向GIPR的药物还有Longevity的LBT-6030、3B Pharmaceuticals的3BP-3775、礼来的GLP-1/GIP/glucagon tri-agonist和诺华的NN-9541,四款药物均处于临床1期。这里值得注意的是Longevity的LBT-6030,LBT-6030是一款GIPR x GLP-1R双靶点激动剂,经Longevity的Hybridtide ®技术修饰。比传统肽相比,利用该技术生产的分子的耐久性和稳定性显著提高。Hybridtides ®可以轻松模仿天然肽和小蛋白的结构,在保留效力和特异性的同时改善整体产品特性。此外,LBT-6030还利用Longevity 口服肽平台进行了优化。
| 药物类型 | 药物 | 靶点 | 适应症 | 公司 | 研发阶段 |
| 生物药 | LBT-6030 | GIPR x GLP-1R | 帕金森病 | Longevity Biotech, Inc. | 临床1期 |
| 诊断用放射药物 | 3BP-3775 | GIPR | 神经内分泌肿瘤 | 3B Pharmaceuticals GmbH | 早期临床1期 |
| 化学药 | GLP-1/GIP/glucagon tri-agonist | GCGR x GIPR x GLP-1R | 糖尿病 | Eli Lilly & Co. | 临床1期 |
| 化学药 | NN-9541 | GIPR x GLP-1R | 2型糖尿病 | Novo Nordisk Pharmaceuticals Pty Ltd. | 临床1期 |
5、缔码GIPR靶点相关产品助力药物研发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供GIPR靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务涵盖多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速GIPR生物疗法的开发,缔码还制备了GIPR靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们目前已筛选出有15个GIPR先导分子,客户第二天可以拿到分子进行功能评估验证,详情欢迎垂询。
- GIPR蛋白&抗体
| 产品类型 | 产品货号 | 产品名称 |
| 全长活性蛋白 | FLP100130 | Human GIPR full length protein-synthetic nanodisc |
| ECD重组蛋白 | PME101267 | Human GIPR Protein, hFc Tag |
| PME-M100109 | Mouse GIPR Protein, hFc Tag | |
| 流式验证抗体 | DMC101001 | Anti-GIPR antibody(3G5); IgG1 Chimeric mAb |
| 参照抗体 | BME100209 | Anti-GIPR(maridebart biosimilar) mAb |
| 生物素标记抗体 | DMC101001B | Biotinylated Anti-GIPR antibody(3G5); IgG1 Chimeric mAb |
| BME100209B | Biotinylated Anti-GIPR(maridebart biosimilar) mAb |
- GIPR先导分子研究进度

参考文献:
[1]Hauser, A., Attwood, M., Rask-Andersen, M. et al. Trends in GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov 16, 829–842 (2017).
[2]Yang, D., Zhou, Q., Labroska, V. et al. G protein-coupled receptors: structure- and function-based drug discovery. Sig Transduct Target Ther 6, 7 (2021).
[3]Lynn FC, Thompson SA, Pospisilik JA, Ehses JA, Hinke SA, Pamir N, McIntosh CH, Pederson RA. A novel pathway for regulation of glucose-dependent insulinotropic polypeptide (GIP) receptor expression in beta cells. FASEB J. 2003 Jan;17(1):91-3.
Regazzo D, Barbot M, Scaroni C, Albiger N, Occhi G. The pathogenic role of the GIP/GIPR axis in human endocrine tumors: emerging clinical mechanisms beyond diabetes. Rev Endocr Metab Disord. 2020 Mar;21(1):165-183.
