一提到DLL3,大家都会想到让艾伯维58亿美金期待落空的DLL3靶点的ADC药物Rova-T。艾伯维的折戟也曾一度让DLL3靶向治疗的热度下降,但是安进在2023年ESMO上公布的DLL3/CD3双抗Tarlatamab数据,让人眼前一亮。同年12月13日,安进还宣布Tarlatamab的BLA申请获FDA受理并获优先审评资格。消息一经发布,靶向DLL3疗法热度持续高涨。那DLL3究竟是什么?目前还有哪些药企布局了靶向DLL3的治疗管线?
1、DLL3的结构与分布
Delta样配体3(Delta-Like Ligand 3, DLL3)是Delta样配体(Delta-like ligands,DLLs)家族成员之一。DLLs是一种附着在细胞表面的单次跨膜蛋白,除了DLL3,该家族还有两位成员DLL1和DLL4。编码DLL1、DLL3和DLL4的基因分别位于染色体 6q27、19q13.2和 15q15.1上 [1]。人DLL3蛋白由619个氨基酸组成,其特征是一个由40个氨基酸组成的N端保守DSL (Delta,Serrate, Lag2)结构域、6个EGF样重复序列和一个跨膜结构域,其中,SDL结构域在配体家族中高度保守,是与Notch受体结合的必要结构。如图1所示,与DLL3不同的是,DLL1和DLL4有8个EGF样重复序列,而且DLL1和4的C端还存在PDZ结合基序,这是DLL3所缺乏的 [2]。DLL3在进化过程中高度保守,人和鼠DLL3蛋白序列同源性可达82%。
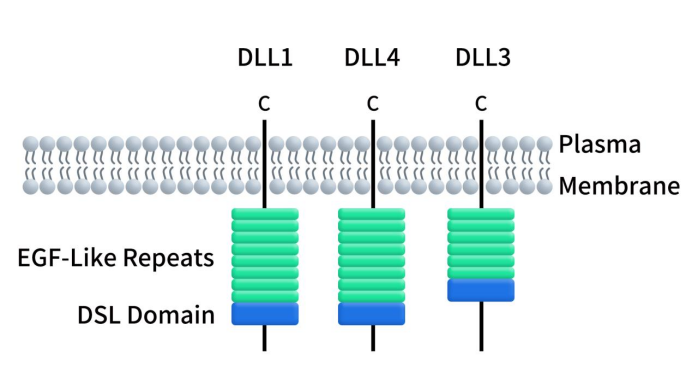
Figure 1. The structure of DLLs [1]
DLL3 RNA主要表达在脑部,内分泌组织以及血液;DLL3单在正常组织中几乎不表达。研究发现,DLL3在大约80%的小细胞肺癌 (SCLC) 和其他神经内分泌肿瘤中高表达。正常细胞和肿瘤细胞中DLL3的差异表达使其成为有吸引力的肿瘤选择性治疗靶点。
2、DLL3与Notch信号通路
DLL3是Notch信号通路的抑制性配体[3],在Notch信号传导中发挥关键作用。Notch通路是高度保守的细胞间信号传导通路,涉及生长发育的多个过程,比如多能祖细胞的分化、细胞凋亡、细胞增殖及细胞边界的形成等。
一般情况下,Notch信号通路通过局部细胞间相互作用调节细胞命运。哺乳动物中有四种 Notch受体(Notch1、Notch2、Notch3、Notch4) 和五种Notch配体(DLL1、3、4和Jagged 1–2)。Notch受体在高尔基体中被furin蛋白酶切割(S1切割)成2个片段后会转运到细胞表面并形成跨膜异二聚体。当与相邻细胞上的Notch配体相互作用后,Notch受体又会发生两次断裂,先是被ADAM10/17在靠近胞膜外的部位催化肽键断裂(S2裂解),然后再由γ-分泌酶复合物(S3裂解)在靠近胞膜内的部位进行切割,从而释放Notch胞内结构域(NICD)。释放的NICD随会进入细胞核与DNA结合蛋白CSL(CBF-1)结合形成NICD/CSL转录激活复合体。该复合体随后会招募MAML(Mastermind-likeprotein)并激活转录Notch靶向的基因,包括Hes、Hey、HERP等转录抑制因子家族 [4] [5]。
DLLs在转运到细胞膜前,在高尔基体中经O-岩藻糖修饰,以增加或者减弱DLL-Notch信号。细胞膜上的DLL结合EGF后,通过胞吞作用顺势激活Notch信号。被胞吞后的DLLs然后被蛋白酶或者溶酶体降解,或者循环后被转运到细胞膜表面。胞吞后的DLLs的降解或者是再循环由泛素化DLL胞内结构域控制(DICD)。DLLs除了可以激活Notch信号外,还可以通过多种途径抑制Notch信号。
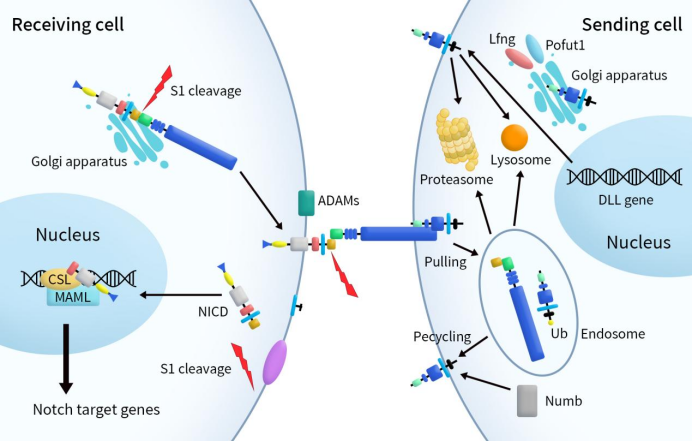
Figure 2. Notch ligands and Notch signaling [6]
再回到DLL3,与其他哺乳动物Notch家族成员不同,在正常发育过程中,DLL3定位于高尔基体和细胞质囊泡,与未加工的全长Notch1和DLL1相互作用,阻止它们定位在细胞表面,从而对Notch信号产生抑制。
3、DLL3与小细胞肺癌
小细胞肺癌(SCLC)是一种低分化的神经内分泌肿瘤,是侵袭性最强的一类肺癌,SCLC的发生进展与 Notch信号通路密切相关,该通路调节许多正常发育所必需的基本过程,此通路失活突变可以诱导非神经内分泌肿瘤细胞或肿瘤前体细胞神经内分泌分化。DLL3是Notch信号通路的唯一抑制性配体,在85%的SCLC中高表达,但在正常肺组织中不表达。这表明DLL3可能与神经内分泌肿瘤发生有关,但其作用机制暂不清楚。此外,DLL3是 achaete-scute 同源物 1 (ASCL1) 的下游靶标,在神经内分泌细胞分化和SCLC 生长中发挥着关键作用。Furuta M [7]等人在一项研究中证明,DLL3过度表达可促进SCLC细胞的生长并增强其迁移和侵袭能力。Deng等也同样发现在小鼠 Lewis肺癌(LLC)细胞中,DLL3通过促进Akt蛋白磷酸化并抑制Notch受体促进了细胞增殖减少细胞凋亡,从而增强小鼠体内的肿瘤生长[8]。除了SCLC,DLL3在大细胞神经内分泌肺癌(LCNEC)、某些其他部位神经内分泌癌和前列腺癌中也表现出高度上调并在细胞表面异常表达,这种差异性异位表达使其成为了潜在的治疗靶点。
4、DLL3靶向疗法临床研究进展
目前,靶向DLL3的疗法共计16项,其中15项在临床阶段,1项处于临床前阶段。疗法类型多样,包括抗体偶联药物(Antibody-drug conjunct, ADC)、CAR-T、蛋白和抗体药。
4.1 DLL3-ADC
Rova-T,全称为Rovalpituzumab tesirine,是一款靶向DLL3的ADC药物。该款ADC药物最初由Stemcentrx原研,2016年AbbVie以58亿美元首付款收购了Stemcentrx,然后接力继续Rova-T的临床开发。目前最新动态是终止开发,针对的适应症为SCLC。Rova-T是由DLL3特异性人源化单克隆抗体通过可裂解的二肽连接子与吡咯并二氮茚(PBD)二聚体毒素偶联。Rova-T通过与细胞表面DLL3结合触发受体介导的内吞作用。内吞作用使Rova-T-DLL3复合物内化进细胞,然后与溶酶体融合。在溶酶体相关组织蛋白酶的作用下,Rova-T 的缬氨酸-丙氨酸接头被裂解,PBD从复合物中释放到细胞质中。细胞质中的PDB随后会进入细胞核,以位点特异性方式插入DNA之间并引起DNA损伤,最终通过细胞凋亡诱导细胞死亡 [9]。
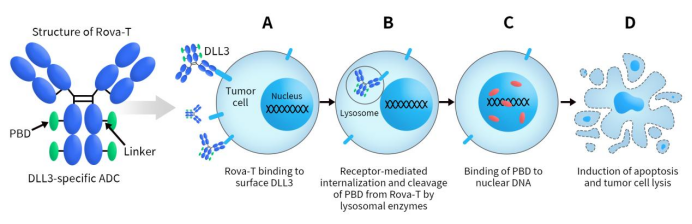
Figure 3. Mechanism of action of Rova-T [10]
Rova-T已开展了至少10项临床试验,包括两项3期临床。2016年,Rova-T的首次人体研究在二三线治疗的SCLC患者中产生了18%的客观响应率(ORR),1年生存率为36%,这一结果给业界带来了极大的振奋,曾一度让DLL3靶点热度持续高涨。基于该结果,AbbVie直接跳过II期临床研究开展了III期研究,但遗憾的是两项III期研究均因未达到预先指定的中期PFS和/或OS主要终点而提前终止。结合结果分析及其他因素考量,AbbVie宣布中断Rova-T的开发。
FZ-AD005,是由复旦张江利用其Linker-Drug平台(BB05平台)第三个新一代ADC产品。该ADC产品通过BB05将重组人鼠嵌合抗DLL3单克隆抗体与拓扑异构酶I抑制剂偶联而成,该药已于2023年12月22日获批临床,拟开发用于治疗晚期实体瘤,包括但不限于小细胞肺癌、大细胞神经内分泌癌、前列腺癌等。
YL212,又称ZL-1310,是由宜联生物具有自主知识产权的TAMLIN ®技术平台研发的一款DLL3 ADC产品。TMALIN®平台为新型抗体偶联药物平台技术,其特点为利用肿瘤微环境来克服当前ADC药物所面临的挑战。不同于传统的胞内裂解,YL212具有胞外及胞内裂解的双重机制,是一款基于新型ADC技术的候选分子。2023年4月27日,再鼎医药和宜联生物就YL212达成战略合作及全球许可协议。2023年12月1日,CDE官方显示,再鼎医药提交注射用ZL-1310的临床申请获得受理。目前正处于临床I期,针对的适应症是癌症。
4.2 DLL3双抗
AMG 757,又称Tarlatamab,是由Amgen开发的一款靶向DLL3和CD3的双抗。于2023年12月BLA申请获FDA受理并获优先审评资格,适应症为二线小细胞肺癌,有望成为全球首款CD3/DLL3双抗。Tarlatamab是一种双特异性T细胞接合器(TCE),对肿瘤细胞上的 DLL3 和 T 细胞上的 CD3 具有双重亲和力。这种双重结合使肿瘤细胞与自体T细胞紧密结合,触发免疫突触的形成和T 细胞激活,并启动多克隆T细胞反应,其特征是 CD3 聚集、T 细胞增殖和释放成孔颗粒酶和穿孔素。这一系列事件最终导致肿瘤细胞凋亡和T细胞反应放大。 Tarlatamab分子由两个单链可变片段(scFv)组成,并包括一个稳定的、无效应器功能的Fc结构域,以增加半衰期。目前,有六项正在进行的临床研究正在评估Tarlatamab。
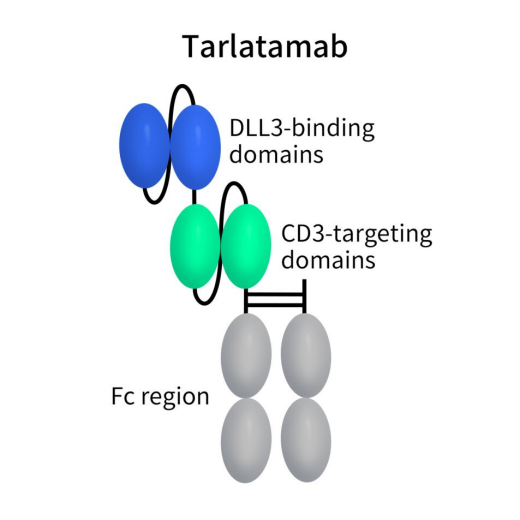
Figure 4. The structure of action of Tarlatamab [10]
QLS31904,由齐鲁制药自主研发,是一款靶向DLL3/CD3的TCE双特异性抗体。该药包括抗DLL3的特异性Fab片段、抗CD3的scFv片段和修饰的Fc区,以支持异二聚体。目前正处于临床I期,拟用于治疗小细胞肺癌等晚期实体瘤。
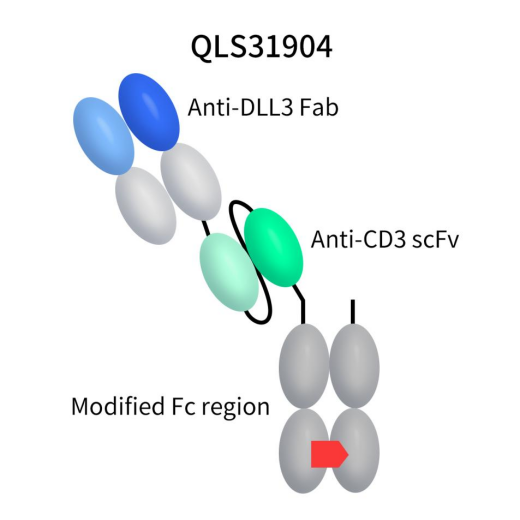
Figure 5. The structure of action of QLS31904 [10]
BI764532,由勃林格殷格翰研发,也是一款具有IgG骨架靶向DLL3/CD3的TCE双特异性抗体。2023年10月,BI 764532获得FDA授予的快速通道资格认证,治疗广泛期小细胞肺癌(SCLC)以及晚期或转移性肺外神经内分泌癌(NEC)。目前,BI764532处于2期临床。
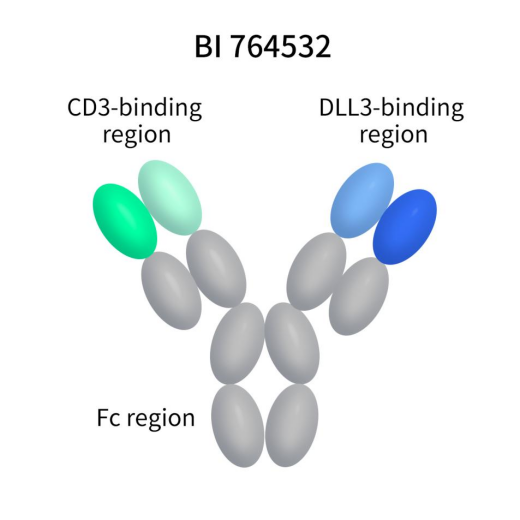
Figure 6. The structure of action of BI764532 [10]
PT-217,由Phanes Therapeutics自主研发,是一款具有天然IgG结构靶向DLL3和CD47的双抗。PT217可通过巨噬细胞的ADCP活性和NK细胞的ADCC活性直接杀伤肿瘤细胞,并通过同时靶向肿瘤细胞表面过度表达的DLL3和CD47扩大肿瘤杀伤范围。此外,PT217有望通过引导肿瘤细胞进入吞噬性抗原呈递细胞(APCs)来诱导肿瘤新抗原的呈递,并通过识别肿瘤新抗原,间接激活T细胞对低表达或不表达DLL3的肿瘤细胞的杀伤,从而刺激获得性免疫系统。PT217的抗CD47单臂具有高度差异化,并且已经在临床前模型中显示,其在与人红细胞最小程度结合的同时,又保持很强的与肿瘤细胞上CD47的结合活性。PT217已于2022年获得美国食品药品监督管理局(FDA)批准在美国开展一项多中心临床I期试验(临床登记号NCT05652686),并于2022年获得了FDA授予的孤儿药资格认定,用于治疗小细胞肺癌。
4.3 DLL3三抗
HPN328,是由Harpoon利用其专有的三特异性T细胞激活构建物(TriTAC®)平台构建的一款三特异性抗体,包括三个人源化抗体衍生的结构域:结合肿瘤细胞上DLL3的N端结构域、结合人血清白蛋白的中间结构域(用于半衰期延长)和结合CD3的C端结构域。HPN328目前正在进行一项1/2期临床试验,该试验旨在评估HPN328单药治疗携带DLL3表达的晚期癌症患者的安全性、耐受性和药代动力学。2024年1月9日,默沙东(MSD)公司宣布将斥资约6.8亿美元收购Harpoon Therapeutics。自此,默沙东将获得一系列T细胞接合器在研疗法,其中包括HPN328,旨在扩展其肿瘤学研发管线。
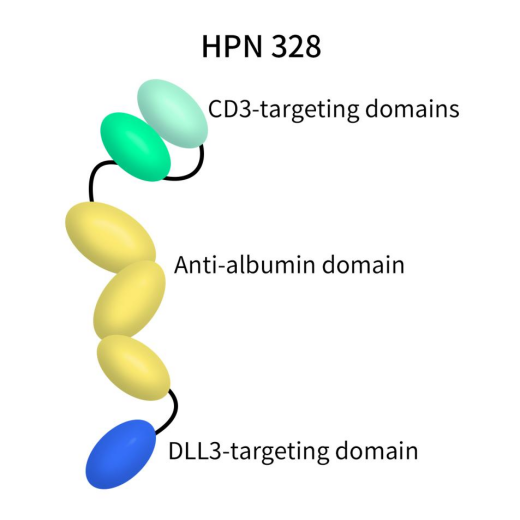
Figure 7. The structure of action of HPN328 [10]
ZG006,由泽璟制药开发,是一款针对CD3及两个不同DLL3表位的三特异性抗体(CD3×DLL3×DLL3)。临床前研究显示,在小鼠肿瘤模型上,ZG006具有显著的肿瘤抑制作用,使小鼠肿瘤完全消退。在非人灵长类动物中,ZG006显示出毒副作用低等良好的安全性特征。目前,ZG006正在进行一项1/2期临床试验,针对的适应症为SCLC。
4.4 DLL3 CAR-T
AMG 119,由Amgen开发的一种CAR-T细胞疗法,包括编码抗DLL3的结构域、CD28和4-1BB共刺激结构域以及CD3胞内结构域。2019年12月,该药被FDA授予孤儿药资格。2023年9月,AMG119在小细胞肺癌患者中的临床治疗概况和PK特征发表在《J Clin Pharmacol》杂志上,结果显示AMG119表现出较强的细胞扩增能力,具有较好的细胞持久性和良好的反应力,并在测试剂量下具有临床安全性和良好的耐受性,没有剂量限制毒性(DLT)。目前,该药正处于临床I期。
ALLO-213,是由Allogene开发的一款靶向DLL3的同种异体CAR-T,目前尚未启动临床。
LB-2102,是由南京传奇开发的一款靶向DLL3双表位的CAR-T 疗法。LB2102使用了VHH抗体技术和克服肿瘤微环境抑制因素的“武装”CAR-T技术。它携带着两个识别DLL3的VHH抗体片段,和一个能被肿瘤微环境中信号激活的跨膜蛋白。2023年6月被FDA授予治疗SCLC的孤儿药资格。 同年11月 ,诺华与传奇生物就LB2102签订独家全球许可协议。
4.5 DLL3 CAR-NK
DLL3 CAR-NK cells是由天津市肿瘤医院开发的一款DLL3 CAR-NK疗法,包含抗DLL3的scFv结构域、NKG2D跨膜结构域和2B4-CD3结构域,目前正在针对复发/难治性ES-SCLC患者进行I期临床试验招募。
5、缔码DLL3相关产品与服务,助力DLL3生物疗法开发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供DLL3靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务包括多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速DLL3生物疗法的开发,缔码还制备了DLL3靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们也针对部分现有的DLL3先导抗体分子进行了CAR-T或ADC分子构建及功能验证,具体数据欢迎垂询。
- 重组活性蛋白
Human DLL3 Protein, hFc Tag (PME100607)
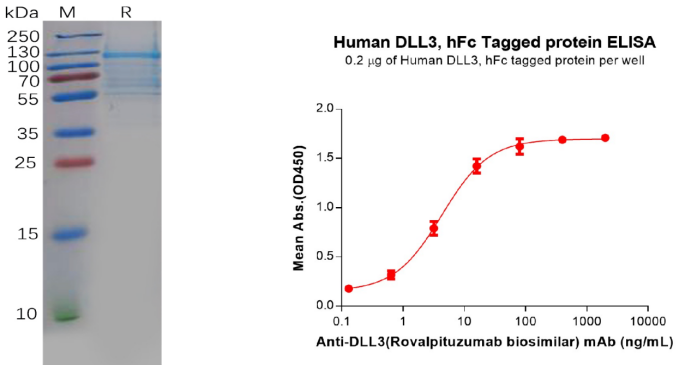
Figure 8. The validated data of PME100607. The purity of the protein is greater than 80% as determined by SDS-PAGE and Coomassie blue staining (left). ELISA plate pre-coated by 2 μg/mL (100 μL/well) Human DLL3 Protein, hFc Tag (PME100607) can bind Anti-DLL3(Rovalpituzumab biosimilar) mAb (BME100068) in a linear range of 0.64–80 ng/mL (right).
- 参照抗体
Anti-DLL3(Rovalpituzumab biosimilar) mAb (BME100068)
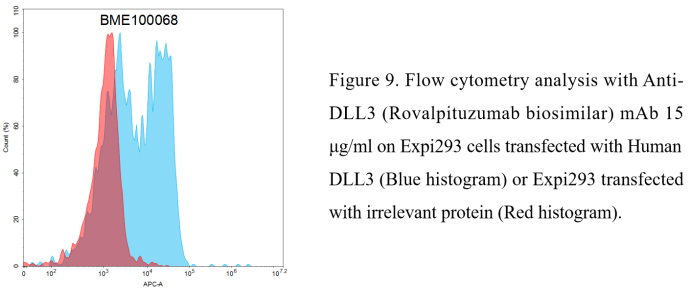
- 流式验证单克隆抗体
Anti-DLL3 antibody(67E6), IgG1 Chimeric mAb (DMC101089)
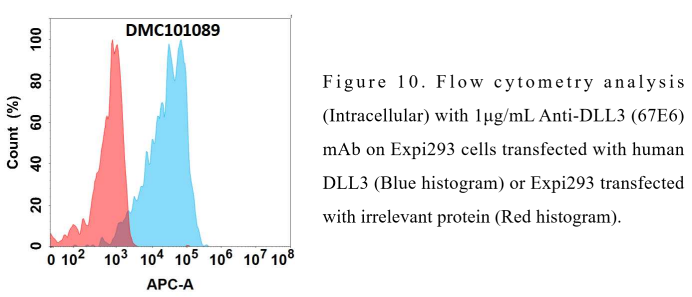
- DLL3产品列表
| 产品类型 | 产品货号 | 产品名称 |
| 多表位重组蛋白 | PME101498 | Human DLL3(352-492) Protein, hFc Tag |
| 多表位重组蛋白 | PME101499 | Human DLL3(390-492) Protein, hFc Tag |
| 多表位重组蛋白 | PME101504 | Human DLL3(311-492) Protein, hFc Tag |
| 多表位重组蛋白 | PME101505 | Human DLL3(428-492) Protein, hFc Tag |
| 多表位重组蛋白 | PME101532 | Human DLL3(176-215) Protein, hFc Tag |
| 多表位重组蛋白 | PME100060 | Human DLL3 Protein, His Tag |
| 多表位重组蛋白 | PME100607 | Human DLL3 Protein, hFc Tag |
| 多表位重组蛋白 | PME-C100062 | Cynomolgus DLL3(272-488) Protein, His Tag |
| 多表位重组蛋白 | PME-C100063 | Cynomolgus DLL3(309-488) Protein, hFc Tag |
| 多表位重组蛋白 | PME-C100064 | Cynomolgus DLL3(388-488) Protein, hFc Tag |
| 多表位重组蛋白 | PME-C100065 | Cynomolgus DLL3(426-488) Protein, hFc Tag |
| 多表位重组蛋白 | PME-C100066 | Cynomolgus DLL3(350-488) Protein, hFc Tag |
| FC验证抗体 | DMC101089 | Anti-DLL3 antibody(67E6), IgG1 Chimeric mAb |
| 参照抗体 | BME100068 | Anti-DLL3(Rovalpituzumab biosimilar) mAb |
| 生物素标记抗体 | DMC101089B | Biotinylated Anti-DLL3 antibody(67E6), IgG1 Chimeric mAb |
| 生物素标记抗体 | BME100068B | Biotinylated Anti-DLL3(Rovalpituzumab biosimilar) mAb |
- DLL3先导分子研究进展

参考文献:
[1]Steinbuck MP, Winandy S. A Review of Notch Processing With New Insights Into Ligand-Independent Notch Signaling in T-Cells. Front Immunol. 2018 Jun 1;9:1230.
[2]Ascano JM, Beverly LJ, Capobianco AJ. The C-terminal PDZ-ligand of JAGGED1 is essential for cellular transformation. J Biol Chem. 2003 Mar 7;278(10):8771-9.
[3]Ladi E, Nichols JT, Ge W, et al. The divergent DSL ligand Dll3 does not activate Notch signaling but cell autonomously attenuates signaling induced by other DSL ligands. J Cell Biol. 2005 Sep 12;170(6):983-92.
[4]Wang MM. Notch signaling and Notch signaling modifiers. Int J Biochem Cell Biol. 2011;43(11):1550–1562.
[5]D’Souza B, Miyamoto A, Weinmaster G. The many facets of Notch ligands. Oncogene. 2008;27(38):5148–5167.
[6]Xiu MX, Liu YM, Kuang BH. The Role of DLLs in Cancer: A Novel Therapeutic Target. Onco Targets Ther. 2020 May 7;13:3881-3901.
[7]Furuta M, Kikuchi H, Shoji T, et al. DLL 3 regulates the migration and invasion of small cell lung cancer by modulating Snail. Cancer Science. 2019 May;110(5):1599-608.
[8]Deng S M, Yan X C, Liang L, et al. The notch ligand delta-like 3 promotes tumor growth and inhibits notch signaling in lung cancer cells in mice[ J]. Biochemical and Biophysical Research Communications,2017,483(1):488-494.
[9]Saunders LR, Bankovich AJ, Anderson WC, et al. A DLL3-targeted antibody-drug conjugate eradicates high-grade pulmonary neuroendocrine tumor-initiating cells in vivo. Sci Transl Med. 2015 Aug 26;7(302):302ra136.
[10]Rudin CM, Reck M, Johnson ML, Blackhall F, Hann CL, Yang JC, Bailis JM, Bebb G, Goldrick A, Umejiego J, Paz-Ares L. Emerging therapies targeting the delta-like ligand 3 (DLL3) in small cell lung cancer. J Hematol Oncol. 2023 Jun 24;16(1):66.


