2022年3月,发表在《Nature Cancer》杂志上的一项研究表明,Cadherin 17 (CDH17)是胃肠道肿瘤(GIC,包括胃癌、胰腺癌、结直肠癌)和神经内分泌肿瘤(NET)嵌合抗原受体T细胞治疗的理想靶点。一时间,CDH17成了各大资讯平台报道的“明星”,同时也为进一步探索肿瘤相关抗原和开发治疗实体肿瘤的安全免疫疗法提供了新的思路。时隔2年,我们来看看目前针对CDH17靶点都有哪些免疫疗法的布局。在此之前,我们先来了解下CDH17的基本信息。
1、CDH17的结构
钙粘蛋白-17(CDH17),又称为肝肠钙粘蛋白(LI-cadherin)或人肽转运蛋白-1 (HPT-1),是钙粘蛋白(cadherin)超家族中结构独特的成员 [1]。cadherin是一类依赖于Ca2+的细胞粘附分子的超家族,属于I型膜蛋白。它们都是单次跨膜蛋白,N末端位于细胞外。cadherin的胞外部分通常由约110个氨基酸模块的多个重复组成,称为钙粘蛋白胞外域(EC),其中包含几个钙粘蛋白特异性基序。经典钙粘蛋白,例如 E-钙粘蛋白(CDH1)、N-钙粘蛋白(CDH2)和P-钙粘蛋白(CDH3),在胞外域内有5个EC结构域,胞内域由150-160个氨基酸组成,高度保守。
与经典钙粘蛋白不同,CDH17属于7D-cadherins,由一个包括七个胞外EC重复结构域、一个单次的跨膜域和一个短的胞质域组成。CDH17的EC1和EC2是源于EC5的两个重复结构域。经典钙粘蛋白EC1中第2位的保守色氨酸在CDH17中被苯丙氨酸取代。CDH17含有RGD 基序,位于EC6结构域中。该基序对于与α2β1整合素的相互作用以及癌症转移细胞中后整合素通路的激活至关重要。除了胞外EC重复结构域数量不同,CDH17和经典钙粘蛋白之间的另一个显着差异是CDH17的非常短(20 个氨基酸)的细胞质结构域,与经典钙粘蛋白的高度保守的细胞质区域(150个氨基酸)或任何其他钙粘蛋白亚家族的细胞质部分没有相似性。特别是无法识别犰狳蛋白(人类中称为β-连环蛋白,β-catenin)的结合位点,而犰狳蛋白是与连环蛋白相互作用以及与细胞骨架相互作用所必需的 [3] [4]。
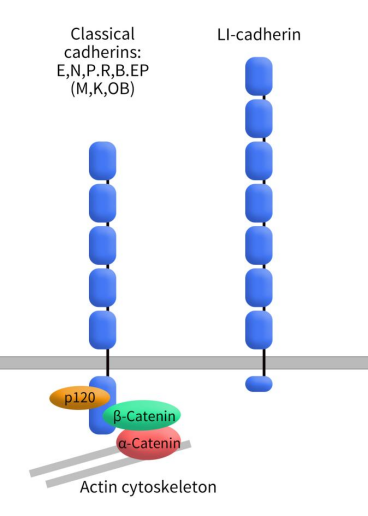
Figure 1. The structure of Classical cadherins and cadherin-17
经典钙粘连蛋白是通过与细胞质内的钙连环蛋白相互作用来调控细胞的粘附功能。尽管CDH17胞质区很短,但其在细胞粘附过程中同样发挥了非常重要的作用。有研究表明,CDH17的胞外部分可能独自担当调节细胞粘附功能的工具。CDH17在细胞粘附过程中并不通过与钙连环蛋白结合而发挥作用,有可能是直接与细胞支架连接而实现细胞之间的粘附。但具有的作用机制尚不明确,还需要进一步研究。
2、CDH17的分布
CDH17最初是在大鼠肝脏和肠道中发现的,所以也被称为肝肠钙粘蛋白。在人体中,CDH17的分布范围仅限于十二指肠、空肠、回肠、结肠以及部分胰腺导管,在健康的成人肝脏、肾脏和心脏等其他组织中很少检测到 [5]。在肠道上皮中,CDH17主要定位在细胞的侧面和基底侧膜上。在肿瘤细胞中,与Claudin18.2等特异性靶点相似,由于缺乏极性,CDH17在肿瘤细胞表面均表达。研究发现,CDH17在胃癌、结直肠癌、胆管癌、胰腺癌及肝细胞癌中均有不同程度的表达。而且,CDH17与多种实体瘤预后相关,在胃癌和结直肠癌患者中其高表达与更短的生存期和疾病无进展相关。
3、CDH17在肿瘤中的作用机制
尽管对于CDH17与肿瘤相关作用机制尚未有明确的解释,但目前对于相关作用机制已开展多项研究。
在肝细胞癌中,John Luk等人发现CDH17粘附分子表达上调,并且在小鼠中可以转化癌前肝脏祖细胞为肝癌。siRNA介导的CDH17敲低可抑制原发性和高度转移性HCC细胞系的体外和体内增殖。CDH17抑制的抗肿瘤机制涉及Wnt信号传导失活,因为生长抑制和细胞死亡伴随着β-catenin重新定位到细胞质,并伴随着细胞周期蛋白D1的减少和视网膜母细胞瘤的增加 [6]。后来Felix H Shek等人又通过实验确定SPINK1为肝细胞癌中CDH17/β-catenin信号轴的下游效应器 [7]。
在胃癌中,Karl-F. Becke等人发现存在CDH17异常剪接体,尤其是伴有外显子8或外显子9缺失的CDH17表达改变在胃癌中占主导地位 [8]。Jin Wang等人验证了CDH17的下调不仅抑制MKN-45胃癌细胞的增殖、粘附和侵袭能力,而且还诱导细胞周期停滞。同时,NFκB信号通路也失活,下游蛋白包括VEGF-C和MMP-9减少。此外,沉默CDH17可显着抑制体内肿瘤生长,并且在没有CDH17表达的小鼠中未检测到淋巴结转移 [9]。
在结肠癌中,CDH17被证明能与α2β1整合素相互作用,并且是α2β1整合素活性调控细胞粘附和增殖的关键决定因素,以及能促进结肠直肠癌细胞获得肝转移的能力。
4、CDH17靶向药临床研究进展
目前针对CDH17靶点的药物几乎都处于早期临床或者临床前研发阶段,但是药物类型十分全面,包括单抗、双抗、CAR-T 和ADC。
4.1 CDH17单抗
PA-0661是由Protein Alternative(简称ProAlt)开发的一款针对钙粘蛋白17-RGD基序(CDH17-RGD)的单克隆抗体,被ProAlt作为治疗晚期转移性结直肠癌(mCRC)的第一个开发候选药物,并已于2018年底完成了抗体人源化。体外和体内实验表明,PA-0661可显著抑制由CDH17-RGD介导的β1整合素的激活,继而抑制细胞粘附、迁移和增殖,从而延迟了所有接受治疗动物的癌症转移进展,并避免了50%的接受治疗个体的转移形成。该药目前仍然处于临床前的人源化和POC确认阶段。
4.2 CDH17双抗
BI905711是勃林格殷格翰(Boehringer Ingelheim)首创的双特异性、四价治疗性抗体,可同时靶向促凋亡肿瘤坏死因子相关凋亡诱导配体受体2(TRAILR2)和CDH17。TRAILR2与CDH17交联诱导CDH17依赖性TRAILR2聚集,在共表达TRAILR2和CDH17的肿瘤细胞中诱导激活选择性凋亡。
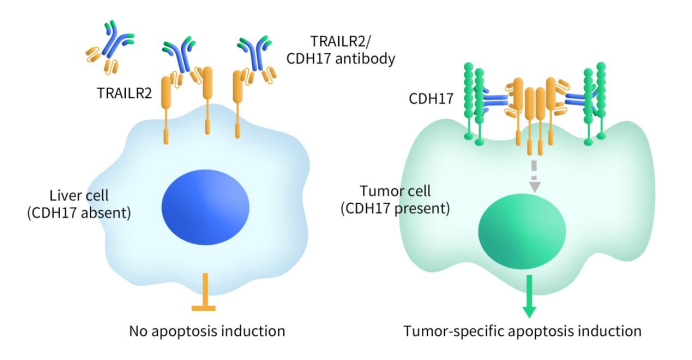
Figure 2. The mechanism of BI905711
临床前实验表明,与第一代TRAILR2激动剂lexatumumab相比,BI 905711效力提高了近1000倍。BI 905711在体外可诱导CDH17阳性肿瘤细胞凋亡,抑制pt来源的结直肠癌(CRC)异种移植物中的肿瘤生长,并且未观察到肝毒性。2020 年9月10日,勃林格殷格翰宣布BI 905711 已进入针对晚期胃肠道 (GI) 癌症患者的首次人体临床试验(NCT04137289)。这项 Ia/Ib期研究旨在确定BI 905711在晚期难治性GI患者中的安全性、最大耐受剂量 (MTD)、药代动力学 (PK)、药效学和初步疗效。目前,这项临床I期研究clinicaltrials.gov显示的状态是完成,但结果暂未公布。
ARB202是Arbele利用TriAx技术构建的一种人源化抗CDH17xCD3的IgG4双抗,对CDH17和CD3独特的差异结合亲和力使其具有高特异性和细胞毒性,在保证高特异性和高杀伤活性的同时,同时避免了T细胞的“脱靶”过度激活。临床前数据显示,ARB202可以有效增加T细胞和表达CDH17的靶癌细胞之间的相互作用。2022年8月,Arbele宣布ARB202进入临床(NCT05411133),用于晚期胃肠道癌症患者治疗。该I期临床研究是一个连续的多中心、开放标签、剂量递增试验,适用于上升剂量和剂量范围,目的是确定ARB202的耐受性和/或使用剂量。该项研究目前正处于招募状态。Arbele在2023年度ASCO突破性会议上公布了其首款CDH17xCD3双特异性T细胞参与抗体ARB 202的早期安全性数据。
Arbele除了ARB202,还有两款CDH17靶向药处于临床前阶段,ARB204和ARB011。ARB204是一款双特异性抗体,同时靶向CDH17和PD-1。ARB011是一款靶向CDH17的CAR-NK疗法。
4.3 CDH17 CAR-T
CHM 2101(CDH17 CAR T)是由Chimeric Therapeutics 开发一款第三代 CDH17 CAR T,具有CD28和4-1BB共刺激结构域。CHM 2101于2023年10月获得FDA IND批准。CHM 2101预计成为首个进入临床的CDH17 CAR T细胞疗法。此次临床试验的获批是建立在2022年3月由领先的免疫治疗科学家Xianxin Hua博士及其团队在宾夕法尼亚大学艾布拉姆森家族癌症研究所发表在杰出科学杂志《Nature Cancer》上的临床前研究的基础上。这些实验表明,CHM 2101能够根除七种癌症模型中已形成的肿瘤,并且对正常组织没有毒性。 随着 FDA IND的批准,Chimeric Therapeutics 将针对CHM 2101开始在晚期结直肠癌、胃癌和神经内分泌肿瘤患者中启动1/2期多中心临床试验(NCT06055439)。该研究计划于 2024 年开始患者入组。
4.4 CDH17 ADC
TORL-3-600是由TORL BioTherapeutic开发的一款新型 CDH17 靶向抗体药物偶联物 (ADC),由完全人源化的 CDH17 mAb 通过MMAE与可裂解接头缀合生成的。TORL-3-600与细胞表面CDH17的结合诱导蛋白质-ADC复合物的内化和易位至溶酶体,以释放MMAE有效负载。临床前研究表明,TORL-3-600在CDH17阳性人结直肠癌模型中能诱导显着消退和肿瘤生长抑制,而且这些模型的反应在停止治疗后可持续长达九周。此外,本研究中测试的每种剂量在小鼠中均具有良好的耐受性,未观察到剂量限制性毒性。目前TORL-3-600正处于I期临床测试 (NCT05948826)。
5、缔码生物CDH17相关产品助力CDH17生物药开发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供CDH17靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务涵盖多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速CDH17生物疗法的开发,缔码还制备了CDH17靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们目前已筛选出有41个CDH17先导分子,其中有36个验证了人猴蛋白交叉反应,客户第二天可以拿到分子进行功能评估验证;针对部分分子,我们也正在进行ADC内吞活性及杀伤验证,具体数据欢迎垂询。
- CDH17蛋白&抗体
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100199 | Human CDH17(567-667) Protein, hFc Tag |
| PME101384 | Human CDH17(567-667) Protein, mFc Tag | |
| PME100801 | Human CDH17 Protein, His Tag | |
| PME-M100098 | Mouse CDH17 Protein, His Tag | |
| PME-C100029 | Cynomolgus CDH17 Protein, His Tag | |
| 流式验证抗体 | DMC100485 | Anti-CDH17 antibody(DMC485); IgG1 Chimeric mAb |
| 参照抗体 | BME100198 | Anti-CDH17(ARB102 biosimilar) mAb |
- CDH17先导分子研究进度

参考文献:
[1] Qiu HB, Zhang LY, Ren C, et al. Targeting CDH17 suppresses tumor progression in gastric cancer by downregulating Wnt/β-catenin signaling. PLoS One. 2013;8(3):e56959.
[2] Baumgartner W. Possible roles of LI-Cadherin in the formation and maintenance of the intestinal epithelial barrier. Tissue Barriers. 2013 Jan 1;1(1):e23815.
[3] Koch PJ, Goldschmidt MD, Walsh MJ, et al. Complete amino acid sequence of the epidermal desmoglein precursor polypeptide and identification of a second type of desmoglein gene. Eur J Cell Biol. 1991;55:200–8.
[4] Koch PJ, Walsh MJ, Schmelz M, et al. Identification of desmoglein, a constitutive desmosomal glycoprotein, as a member of the cadherin family of cell adhesion molecules. Eur J Cell Biol. 1990;53:1–12.
[5] Gessner R, Tauber R. Intestinal cell adhesion molecules. Liver-intestine cadherin. Ann N Y Acad Sci. 2000;915:136-43.
[6] Liu LX, Lee NP, Chan VW, et al. Targeting cadherin-17 inactivates Wnt signaling and inhibits tumor growth in liver carcinoma. Hepatology. 2009 Nov;50(5):1453-63.
[7] Shek FH, Luo R, Lam BYH, et al. Serine peptidase inhibitor Kazal type 1 (SPINK1) as novel downstream effector of the cadherin-17/β-catenin axis in hepatocellular carcinoma. Cell Oncol (Dordr). 2017 Oct;40(5):443-456.
[8] Karl-F. Becker, Michael J. Atkinson, Ulrike Reich, Hsuan-H. Huang, Hjalmar Nekarda, Jörg R. Siewert, Heinz Hofler, Exon skipping in the E-cadherin gene transcript in metastatic human gastric carcinomas, Human Molecular Genetics, Volume 2, Issue 6, June 1993, Pages 803–804.
[9] Wang J, Kang WM, Yu JC, Liu YQ, Meng QB, Cao ZJ. Cadherin-17 induces tumorigenesis and lymphatic metastasis in gastric cancer through activation of NFκB signaling pathway. Cancer Biol Ther. 2013 Mar;14(3):262-70.