截止至2023年12月31日,据美国FDA官网数据显示,2023年度,共有55款新药在FDA获批上市,其中小分子药物有28款,占总获批药物数量51%;抗体药有12款;其余的15款药物含核酸和多肽类药物、酶替代疗法和基因疗法,占总批准药物的27%。这里重点罗列了FDA在2023年批准上市的12款抗体药,其中包括8款单抗,4款双抗,快来看看你感兴趣的靶点是否也在里面。
1、双抗类药物
1.1 Elrexfio
Elrexfio,又称为elranatamab-bcmm,是由辉瑞开发的一款同时靶向结合BCMA和CD3的双特异性抗体,于2023年8月14日获FDA批准上市。Elrexfio可通过结合骨髓瘤细胞上的BCMA和T细胞上的CD3,将两种细胞聚集在一起并激活T细胞杀死骨髓瘤细胞。该药可用于治疗复发或难治性多发性骨髓瘤(RRMM)的成人患者,这些患者至少接受过四种包括蛋白酶体抑制剂、免疫调节剂和抗CD38单克隆抗体在的治疗。此前,FDA授予ELREXFIO孤儿药资格与突破性疗法认定,同时也赋予了优先审评资格。
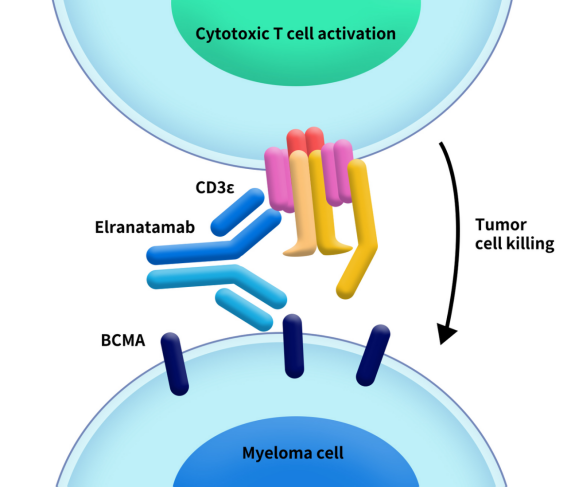
Figure 1. The mechanism of Elrexfio
该药此次加速获批是基于MagnetisMM-3(NCT04649359)II期研究的积极结果。该临床试验是一项单臂、开放标签、多中心的研究,旨在评估ELREXFIO治疗RRMM患者的安全性和有效性。
ELREXFIO在此项研究中治疗了从未接受过 BCMA 导向治疗但之前接受四种或更多治疗的患者(n=97),总缓解率(ORR)为57.7%,其中估计有82%的患者维持至少9个月的缓解。首次出现缓解的中位时间为1.1个月。此外来自MagnetisMM-3队列B(n=64)的数据显示,在该队列中接受过至少四种治疗的63名患者中,包括BCMA定向治疗(CAR-T或ADC),中位随访10.2个月后ORR为33%,其中估计84%的患者维持至少九个月的缓解。
1.2 Talvey
Talvey,又称为Talquetamab-tgvs,是由强生公司开发的一款GPRC5D/CD3双抗药物,于2023年8月9日获FDA批准上市。Talvey是一种双特异性T细胞结合抗体,可以同时结合T细胞上的CD3和癌细胞上的GPRC5D。在体外,Talvey可通过激活T细胞,引起促炎细胞因子的释放,导致多发性骨髓瘤细胞的溶解死亡。该药在小鼠多发性骨髓瘤模型中表现出显著的抗肿瘤活性。
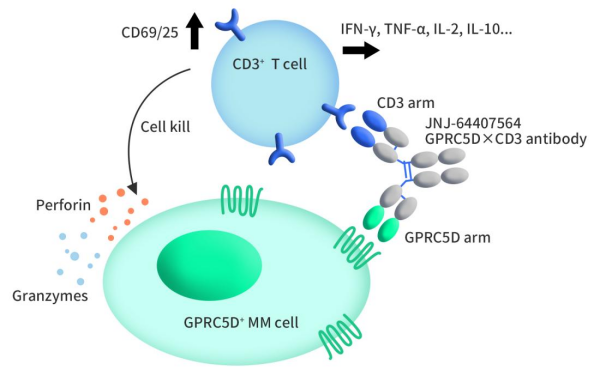
Figure 2. The mechanism of Talvey [1]
FDA的批准是基于MonumenTAL-1试验(NCT03399799&NCT04634552)的数据,这是一项1/2期单臂、开放标签、多队列、多中心、剂量递增研究,旨在评估TALVEY在接受过三线或更多线治疗的复发或难治性多发性骨髓瘤成人中的安全性和有效性。关于GPRC5D更多临床研究进展>>
1.3 Columvi
Columvi,又称为glofitamab-gxbm,是由罗氏子公司Genentech开发的一款CD20/CD3双特异性抗体,于2023年6月15日获FDA批准上市。该药可用于治疗接受过2线及以上系统性治疗的复发/难治性(R/R)非特指型弥漫性大B细胞淋巴瘤(DLBCL)或滤泡性淋巴瘤引起的大B细胞淋巴瘤(LBCL)。作为一个抗体,Columvi的两条臂并不一样,一侧的Fab段是中规中矩的CD20结合位点,而另一侧则是将一个抗CD20 Fab和一个抗CD3 Fab柔性头尾相接,即具有2:1比例的CD20和CD3结合位点。抗CD20 Fab结合癌细胞,抗CD3 Fab结合T细胞。与1:1结构的TCB相比,Columvi具有更强的B细胞抓取能力,可诱导更紧密和稳定的T细胞-癌细胞免疫突触。
FDA此次加速批准是基于NP30179(NCT03075696)临床数据。NCT03075696是一项开放标签、多中心、单臂研究,旨在评估Columvi单药治疗RRMM患者的疗效。此项研究共纳入132例患者,其中80%的患者为R/R非特指型DLBCL,20%的患者为滤泡性淋巴瘤引起的LBCL。
研究结果显示,接受Columv固定持续时间治疗的患者获得了持久缓解,56%(74/132)的患者获得了总体缓解(OR),43%的患者获得了完全缓解(CR)。超过三分之二的应答者持续应答至少9个月。中位缓解持续时间为1.5年(18.4个月)。
1.4 Epkinly
Epkinly,又称为epcoritamab-bysp,是由Genmab和艾伯维共同开发的CD20×CD3 T细胞接合双特异性抗体,于2023年5月19日获FDA批准上市。该药可用于经过两线或多线系统性治疗后复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL),包括由惰性淋巴瘤引起的DLBCL和经过两个或更多系统治疗后的高级B细胞淋巴瘤。
此次的批准是基于I/II期EPCORE NHL-1试验的研究结果中的缓解率和缓解持续时间。在这项旨在评估Epkinly治疗弥漫性大B细胞淋巴瘤患者疗效和安全性的试验中,疗效人群包括148例弥漫性大B细胞淋巴瘤患者。在所有接受Epkinly治疗的患者中,ORR为61%,CR为38%,PR为23%。中位缓解持续时间(DOR)为15.6个月;9个月的DOR率为63%。
与竞品1.3Columvi相比,Epkinly 是皮下注射制剂,Columvi是静脉输注药物,Epkinly临床应用具有便利的优势。此外,Epkinly获批的适应症比Columvi要多一些,主要是高级别B细胞淋巴瘤。
2、单抗类药物
2.1 Loqtorzi
Loqtorzi,又称为toripalimab-tpzi,是由Coherus和君实生物合作开发的PD-1单抗,于2023年10月27日获FDA批准上市。Loqtorzi单药获批用于复发或转移性鼻咽癌含铂治疗后的二线及以上治疗,其与吉西他滨/顺铂的联合疗法可作为晚期复发或转移性鼻咽癌(NPC)患者的一线治疗。值得注意的是,该单抗是首个FDA批准用以治疗鼻咽癌的药物。Loqtorzi获批是基于JUPITER-02及POLARIS-02的研究结果。JUPITER-02是一项随机、双盲、安慰剂对照、国际多中心 III 期临床研究;POLARIS-02是一项多中心、开放标签、II 期关键注册临床研究。
在JUPITER-02临床3期研究中,与单独化疗相比,特瑞普利单抗联合化疗显著改善患者的无进展生存期(PFS),将疾病进展或死亡风险降低了48%。该药物还显示总生存期(OS)出现具有统计学显著性和临床意义的改善,与单独化疗相比,特瑞普利单抗导致死亡风险降低37% [2]。
在POLARIS-02临床研究中,特瑞普利单抗在既往化疗失败的复发性或转移性NPC患者中表现出持久的抗肿瘤活性,客观缓解率(ORR)为20.5%,疾病控制率(DCR)为40.0%,中位OS为17.4个月,安全性特征可接受 [3]。
2.2 Omvoh
Omvoh,又称为mirikizumab-mrkz,是由礼来开发的一种人源化IgG4单克隆抗体,可与IL-23的p19亚基结合,阻断IL-23介导的炎症反应。该药已于2023年10月26日获FDA批准上市,用于治疗成人中度至重度活动期溃疡性结肠炎(UC)。Omvoh是首个也是唯一一个用于治疗成人中度至重度活动期溃疡性结肠炎(UC)的白细胞介素-23p19 (IL-23p19)拮抗剂;也是唯一选择性靶向IL-23的p19亚单位的UC治疗。
该批准基于LUCENT-1诱导研究(NCT03518086)和LUCENT-2维持研究(NCT03524092)两项研究。LUCENT-1诱导研究和LUCENT-2维持研究是两项随机、双盲、安慰剂对照3期临床试验,前者为期12周,后者为期40周。
2.3 Bimzelx
Bimzelx,又称为bimekizumab,是由优时比(UCB)开发的一种新型人源化单克隆IgG1抗体,于2023年10月17日获FDA批准上市。该药是首个获批用于治疗中重度斑块状银屑病的白介素-17 A/F(IL-17A/F)抑制剂。Bimzelx是一款全人源化单抗,能够强力且选择性地中和IL-17A和IL-17F。IL-17A和IL-17F是驱动炎症过程的2种关键细胞因子,具有相似的促炎功能,在多种发炎的人体组织中均上调。它们能独立地与其他促炎因子(如TNF)合作,继而放大炎症反应。
Bimzelx的获批基于3项3期临床研究(BE VIVID、BE READY、BE SURE)的结果支持。这些研究评估了bimekizumab治疗中重度斑块型银屑病成人的疗效和安全性。所有研究均达到了共同主要终点和次要终点。
2.4 Veopoz
Veopoz,又称为pozelimab-bbfg,是由再生元开发的一种针对末端补体蛋白C5的人单克隆免疫球蛋白G4P (IgG4P)抗体,于2023年8月18日获FDA批准上市。Veopoz是一种C5补体抑制剂,可通过阻断C5裂解为C5a(过敏毒素)和C5b,从而阻断膜攻击复合物(C5b- C9,一种介导细胞裂解的结构)的形成,从而抑制末端补体活化。该药目前适用于1岁及以上患有CD55缺乏性蛋白丢失性肠病(PLE)的成人和儿童患者,也称为CHAPLE病。本次获FDA批准上市是基于一个招募了10名患者临床II期/III期的单臂研究(NCT04209634),该研究评估了Veopoz的有效性和安全性。
2.5 Beyfortus
Beyfortus,又称为nirsevimab-alip,是由阿斯利康(AstraZeneca)和赛诺菲(Sanofi)合作开发的单克隆长效抗体注射液,于2023年7月17日获FDA批准上市。nirsevimab结合的位点在融合前构象的RSV病毒F蛋白,这一状态是RSV 病毒最“脆弱”的时刻。该药主要用于预防婴儿呼吸道合胞病毒 (RSV) 导致的下呼吸道感染 (LRTI),是目前全球首个且唯一一个可广泛应用于婴儿人群的单剂次RSV预防手段,包括足月或早产的健康婴儿,或健康状况特殊的婴儿。
Beyfortus的上市获批是基于MELODY临床3期(NCT03979313)、MEDLEY临床2/3期(NCT03959488)与一项临床2b试验(NCT02878330)的结果。试验NCT02878330纳入了1,453 名胎龄29-35周的健康早产儿。其中,969名接受单剂Beyfortus,484 名接受安慰剂。研究结果显示,在接受 Beyfortus治疗的婴儿中,有 25 名(2.6%)出现 就医 RSV 下呼吸道感染(MA RSV LRTI),而接受安慰剂的婴儿有 46 名(9.5%)。与安慰剂相比,Beyfortus 将 MA RSV LRTI 的风险降低了约 70%。
2.6 Rystiggo
Rystiggo,又称为rozanolixizumab-noli,是由优时比(UCB)开发的一种皮下注射的人源化单克隆抗体,于2023年6月26日获FDA批准上市。该抗体以高亲和力特异性结合人类新生儿Fc受体 (FcRn),旨在阻断FcRn和免疫球蛋白 G (IgG) 的相互作用,加速抗体的分解代谢并降低致病性IgG自身抗体的浓度。目前,FDA已批准其用于治疗抗乙酰胆碱受体(AChR)或抗肌肉特异性酪氨酸激酶(MuSK)抗体阳性的成人全身型重症肌无力(gMG),也是当前FDA针对该适应症唯一批准的一款新药。FDA对Rystiggo的批准基于其III期MycarinG研究(NCT03971422)中收集的安全性和疗效数据。
2.7 Zynyz
Zynyz,又称为retifanlimab-dlwr,是由美国因赛特公司开发的一种程序性死亡受体-1(PD-1)阻断抗体,于2023年3月22日获FDA批准上市。 该抗体通过与PD-1受体结合,抑制PD-1介导的免疫细胞活性抑制作用,提高免疫细胞发现和杀伤肿瘤细胞的能力,适用于治疗患有转移性或复发性局部晚期默克尔细胞癌的成人患者。此次批准是基于一项开放标签、单臂的POD1UM-201试验数据。
2.8 Leqembi
Leqembi,又称为lecanemab-irmb,是由渤健(Biogen)和日本制药卫材(Eisai)联合开发的一种针对Aβ靶点的人源化IgG1单克隆抗体,于2023年1月6日获FDA批准上市。Leqembi能够高亲和力结合可溶性淀粉样β原纤维(aβ),可用于治疗早期阿尔茨海默病的新药。
3、缔码生物抗体药物先导分子开发一站式解决方案
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。公司拥有DiMProTM功能性膜蛋白开发、缔码单克隆抗体单B细胞先导抗体分子发现、DiLibraryTM抗体工程改造和抗体功能验证四大技术平台,可提供从抗原制备、抗体先导分子筛选到抗体先导分子功能验证的一站式服务。
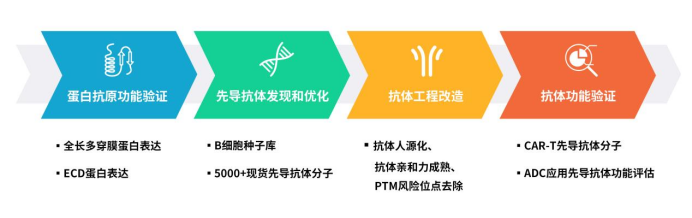
Figure 3. DIMA’s One-stop service for drug lead mAb development
缔码利用DiMProTM功能性膜蛋白开发平台已成功制备2000+ECD蛋白、100+多穿膜全长活性蛋白。3年内,缔码通过缔码单克隆抗体单B细胞先导抗体分子发现平台已完成300+药物靶点预制先导抗体分子的制备,客户可即刻引进抗体分子序列及功能验证数据包。针对每个靶点都有多个不同来源免疫动物的预制B细胞种子库,最快可实现20天筛选先导分子。截止到2023年底,缔码通过其抗体功能验证平台已对30+靶点完成了CAR-T体外功能验证,对50+靶点完成了ADC体外功能验证,关于验证靶点详情,欢迎拨打电话400-006-0995 / 18062749453进行咨询。
参考文献:
[1]Kodandaram Pillarisetti, Suzanne Edavettal, Mark Mendonça, et al; A T-cell–redirecting bispecific G-protein–coupled receptor class 5 member D x CD3 antibody to treat multiple myeloma. Blood 2020; 135 (15): 1232–1243.
[2]DOI: 10.1200/JCO.2021.39.15_suppl.LBA2 Journal of Clinical Oncology 39, no. 18_suppl Published online June 16, 2021.
DOI: 10.1200/JCO.20.02712 Journal of Clinical Oncology 39, no. 7 (March 01, 2021) 704-712.

