2023年12月,葛兰素史克(“GSK”)斥资17.1亿美元从翰森制药获得开发、生产及商业化HS-20093全球独占许可权利(不含中国大陆、香港、澳门及台湾地区)。HS-20093是翰森制药自主研发的一种新型B7-H3靶向抗体药物偶联物(ADC)。无独有偶,2024年4月,Macrogenics因公布B7H3 ADC新药vobramitamab duocarmazine(MGC-018)治疗去势抵抗前列腺癌二期临床TAMARACK的最新数据,当天股价大涨30%。B7-H3也因此被认为是极具潜力的ADC靶点。那B7-H3究竟是什么?在肿瘤的发生发展中又扮演什么角色?除了ADC,还有哪些靶向B7-H3的疗法,又有哪些药企布局该靶点?
1、B7-H3结构与分布
B7 homolog 3(B7-H3),又称为CD276,属于免疫调节蛋白B7家族。同属于B7家族的成员还有:B7-1(CD80)、B7-2(CD86)、B7-DC(PD-L2或CD273)、B7-H1(PD-L1或CD274)、B7-H2(ICOSLG)、B7-H4(VTCN1)、B7-H5(VISTA)、B7-H6(NCR3LG1)和 B7-H7(HHLA2) [1]。B7家族被证明为T 细胞激活中的共刺激或共抑制分子,其配体和受体在适应性免疫反应和恶性肿瘤中发挥关键作用。
B7-H3首次是2001年从人类树突细胞(DC)的cDNA文库中克隆出来[2]。B7-H3与其他B7家族成员具有20-27%的氨基酸同一性。B7-H3的氨基酸序列在小鼠和人中的同源性可达 88% [3],尽管存在这种相似性,但人类 B7-H3 特异性抗体不会与鼠细胞上表达的内源性鼠 B7-H3 发生交叉反应 [4]。小鼠和人中编码B7-H3 蛋白的基因分别位于第 9 号染色体和第 15q24 号染色体上。
人B7-H3蛋白以跨膜亚型或可溶亚型存在。跨膜B7-H3是由316个氨基酸组成的I型跨膜蛋白,分子量约为 45-66 kDa,由胞外域、跨膜域和短胞内域组成。根据其胞外结构域,B7-H3 存在两种亚型。一是4IgB7-H3(4Ig VCVC),其包含两对相同的IgV样和IgC样结构域;二是2IgB7-H3(2Ig VC),其包含单对IgV样和IgC 样结构域。其中,4IgB7-H3 是人类的主要亚型。值得注意的是,小鼠中的B7-H3仅表达为2IgB7-H3亚型。可溶性B7H3由基质金属蛋白酶切割而来,并且可溶性B7H3包含结合B7H3受体结构域,是一种结合受体的活性形式。添加基质金属蛋白酶抑制剂 (MMPI) 可阻止 B7-H3 从细胞中释放,同时导致 B7-H3 在细胞表面积累 [5]。存在可溶亚型的主要是2IgB7-H3亚型,因为4IgB7-H3 的第一个IgC 结构域中会产生一个新的保守区域,这可能会阻止4IgB7-H3 释放可溶形式 [6]。

Figure 1. The structure of B7-H3 (transmembrane isoform)
2、B7-H3在肿瘤发生发展中的作用
B7-H3可同时作为共刺激分子和/或共抑制分子,这主要取决于所涉及的免疫细胞和微环境条件。它在肿瘤发生发展、免疫逃逸等多个过程中发挥作用,与肿瘤的不良预后相关。B7-H3 通过免疫学和非免疫学途径影响免疫反应和癌症进展。尽管B7-H3的受体尚未确定,但推测活化的CD4 +和CD8 + T细胞表达的受体可以被抗原呈递细胞(APC)或肿瘤细胞上表达的 B7-H3识别[ 8]。B7-H3的2IgB7-H3和4IgB7-H3亚型可抑制T细胞增殖并下调细胞因子的产生 [ 9 ]。B7-H3的表达可通过促进IL-10、TGF-β1分泌来抑制微环境[ 10 ],并抑制CD4 + T细胞、CD8 + T细胞、γδT细胞、CAR-T细胞、Vδ2T的活性细胞、Th17细胞、CD3 + T细胞、NK细胞、巨噬细胞、中性粒细胞、树突状细胞,还抑制IFN-γ、IL-2、穿孔素、颗粒酶B的分泌。
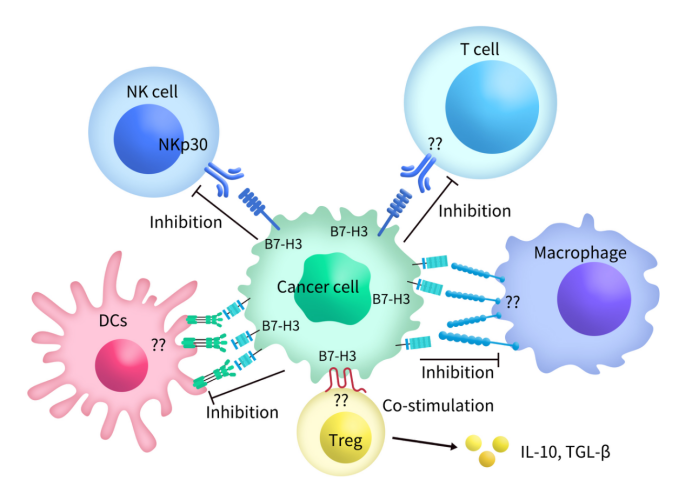
Figure 2. A diagram of the interaction of cancer cell-expressed immune checkpoint B7-H3 with immune cells [11]
除了调节免疫微环境外,据报道B7-H3还可以激活癌细胞中的ERK、PI3K和Stat3等信号通路,这可能导致细胞增殖和肿瘤生长加速 [12]。
3、靶向B7-H3疗法研究进展
B7-H3在肿瘤组织和正常组织中的差异表达以及B7-H3在促进肿瘤方面的作用使得B7-H3已成为新的免疫治疗靶点。尽管目前比较火的是B7-H3 ADC,但关于B7-H3单抗、双抗和CAR-T疗法也在有序开展。据不完全统计,目前针对B7-H3靶点开发的生物药总共有109款,但处于临床阶段的只有33款,其中以ADC和CAR-T疗法为主。
3.1 B7-H3 ADC
目前,临床上B7-H3 ADC药物共计12款,其中处于临床III期的有1款,临床II期的有3款,剩下的除了3款处于临床I期,其余的均处于临床I/II期。
Ifinatamab deruxtecan(I-DXd),又称作DS 7300或DS-7300或DS-7300A,是第一三共基于其DXd ADC技术平台开发的一款B7H3 ADC,也是2023年与默沙东达成合作开发的项目之一。在这项合作中,第一三共授权包括I-DXd在内的三款DXd ADCs日本以外地区的商业化权益,总金额达$220亿美元。I-DXd是由人源化B7-H3 IgG1抗体与DXd通过可裂解连接子MC-GGFG偶联组成的ADC,目前全球最高研发状态是临床III期(NCT06203210)。该项研究旨在评估I-DXd在复发性小细胞肺癌 (SCLC)患者中与其他疗法的疗效与安全性,现在这项临床研究正处于招募状态。该药物也是首款进入III期阶段的B7H3 ADC。目前,针对I-DXd在临床上开展的适应症除了复发性SCLC,还有非小细胞肺癌、广泛期小细胞肺癌、晚期恶性实体瘤、去势抵抗性前列腺癌和食管鳞状细胞癌。
vobramitamab duocarmazine,又称作AEX4089DC1或MGC 018,是由MacroGenics开发的一款B7H3 ADC。MGC 018有B7-H3 IgG1抗体经蛋白酶可裂解连接子Vc-seco-DUBA与有效载荷Seco-duocarmycin偶联,DAR值为2.7。目前全球最高研发状态为临床II期(NCT06227546和NCT05551117),针对的适应症包括复发或难治性广泛期小细胞肺癌 (ES-SCLC) 、转移性去势抵抗性前列腺癌和其他实体瘤。NCT06227546的目标是在复发或难治性ES-SCLC患者中测试MGC018,开始日期为2024年4月15日,目前正处于招募状态。NCT06227546是一项在转移性去势抵抗性前列腺癌和其他实体瘤患者中评估MGC 018的II期开放标签研究,于2023年6月13日开始。2024年4月3日,Macrogenics在2024年度ASCO会议上公布二期临床试验NCT06227546的结果。截至2024年1月4日,在接受MGC 018治疗(2.0mg/kg剂量组91例,2.7mg/kg剂量组86例),因副作用停止治疗的比例分别分别为4.4%和2.3%,没有副作用致死案例。此结果一经公布,Macrogenics当日股价大涨30%。
HS-20093是由翰森制药开发的一款靶向B7-H3 ADC,由全人源化的B7-H3单抗与拓扑异构酶抑制剂(TOPOi)有效载荷通过可被蛋白酶剪切的连接子共价连接而成,DAR值为4。2023年12月20日,翰森制药与葛兰素史克(GSK)达成许可协议,GSK将获得中国以外地区的独占许可,以开发、生产和商业化HS-20093。尽管具体完整金额暂未披露,但上海翰森生物将获得1.85亿美元首付款,并有资格就该产品收取最多15.25亿美元的里程碑付款。HS-20093目前全球最高研发状态为临床II期(NCT06052423、NCT06112704和NCT06001255),针对的适应症包括广泛期小细胞肺癌、实体瘤、食管癌及转移性去势抵抗性前列腺癌。2023年6月,翰森制药在美国临床肿瘤学会(ASCO)上公布了HS-20093的一期研究结果(NCT05276609),结果显示HS-20093的安全性可控,最大耐受剂量(MTD)为12.0 mg/kg,并且在多种现有标准治疗失败或不耐受标准治疗的晚期实体瘤受试者中显示出优异的抗肿瘤疗效,特别是在小细胞肺癌中疗效更优。
| 药品类别 | 药品名称 | 研发机构 | 全球最高研发阶段 |
| ADC | ifinatamab deruxtecan | Merck & Co.&Daiichi Sankyo | III期 |
| ADC | vobramitamab duocarazine | MacroGenics | II期 |
| ADC | HS-20093 | GSK&翰森制药 | II期 |
| ADC | YL201 | 宜联生物 | II期 |
| ADC | 7MW3711 | 迈威生物 | I/II期 |
| ADC | DB-1311 | BioNTech&映恩生物 | I/II期 |
| ADC | IBI129 | 信达生物 | I/II期 |
| ADC | IBI3001 | 信达生物 | I/II期 |
| ADC | MHBO88C | 明慧医药 | I/II期 |
| ADC | MGC-026 | MacroGenics | I期 |
| ADC | Mirzotamab clezutoclax | AbbVie, Inc. | I期 |
| ADC | BAT8009 | 百奥泰 | I期 |
3.2 B7-H3 CAR-T
目前临床上开展的B7-H3 CAR-T疗法共计12款(包含2款自体CAR-T),除了两款处于I/II期临床外,其余均处于I期临床。其中,Seattle Children’s Hospital和博生吉医药科技(PersonGen BioTherapeutics (Suzhou) Co., Ltd.)各有两款B7-H3 CAR-T疗法。
Seattle Children’s Hospital的两款CAR-T疗法(B7H3 CAR T Cell和SCRI-CARB7H3),与SCRI-CARB7H3不同的是,B7H3 CAR T Cell是一款双靶向CAR-T,可同时靶向CD19和B7-H3,二者均处于临床I期。博生吉医药的两款CAR-T疗法(TAA6-CAR-T和UTAA06),二者也都处于临床I期,其中TAA6-CAR-T(又称为TAA06)与2022年3月,先后获得FDA的罕见儿科疾病和孤儿药的特殊审评,针对的适应症为神经母细胞瘤。而且,博生吉医药和Transgene SA就TAA6-CAR-T疗法于2022年1月达成合作,但合作细节暂未披露。
| 药品类别 | 药品名称 | 研发机构 | 全球最高研发阶段 |
| CAR-T | 4SCAR-276 | 深圳市免疫基因治疗研究院 | I/II期 |
| CAR-T | Allogenic B7H3 CAR-γδT cell(QH104) | 苏州大学附属第四附属医院 | I/II期 |
| CAR-T | Anti B7 H3 CAR-T-cell therapy (BP-102) | 博源润生&北京天坛医院 | I期 |
| CAR-T | B7 H3 CAR-T-cell therapy (TCB 005) | TC Biopharm Ltd. | I期 |
| CAR-T | B7-H3-CAR T cells(St. Jude Children’s Research Hospital) | St. Jude Children’s Research Hospital, Inc. | I期 |
| CAR-T | B7H3 CAR T Cell(Seattle Children’s Hospital) | Seattle Children’s Hospital | I期 |
| CAR-T | SCRI-CARB7H3 | Seattle Children’s Hospital | I期 |
| CAR-T | TAA6-CAR-T | PersonGen BioTherapeutics (Suzhou) Co., Ltd. | I期 |
| CAR-T | UTAA06 | PersonGen BioTherapeutics (Suzhou) Co., Ltd. | I期 |
| CAR-T | TX-103 | Fuzhou Tuoxin Tiancheng Biotechnology Co., Ltd. | I期 |
| 自体型CAR-T | B7H3 IL-7Ra CAR T Cell (University of Chulalongkorn) | University of Chulalongkorn | I期 |
| 自体型CAR-T | CAR.B7-H3T cells(UNC Lineberger Comprehensive Cancer Center) | UNC Lineberger Comprehensive Cancer Center | I期 |
3.3 B7-H3双特异性抗体&单克隆抗体&融合蛋白
目前临床上靶向B7-H3的双特异性抗体药物共计4款,单克隆抗体有2款,1款融合蛋白,其中临床进展最快的是MacroGenics, Inc.开发的Enoblituzumab,目前处于临床II期,但试验已暂停。
Enoblituzumab是Fc增强的单克隆抗体,是含有一个Fc结构域的完全人源化的单抗,通过增加其与活化受体CD16A的结合并减少其与抑制受体CD32B的结合来增强其抗肿瘤功能。MacroGenics和天境生物技术于2019年7月达成合作总金额为$1.5亿美金的合作协议,天境生物获得Enoblituzumab在中国大陆、香港、澳门及台湾地区的独家开发及商业化的权利。但2022年7月8日,MacroGenics公司宣布停止其B7-H3单抗Enoblituzumab联合其它免疫检查点药物(PD-1单抗或PD-1/LAG-3双抗)治疗复发难治性头颈鳞癌的II期临床试验CP-MGA271-06的研究。
| 药品类别 | 药品名称 | 研发机构 | 全球最高研发阶段 |
| 双特异性抗体 | IBI-334 (B7-H3xEGFR) | Innovent Biologics (Suzhou) Co. Ltd. | I/II期 |
| 双特异性抗体 | TAK-280(B7-H3xCD3) | Maverick Therapeutics, Inc. | I/II期 |
| 双特异性抗体 | Orlotamab(B7-H3xCD3) | MacroGenics, Inc. | I期 |
| 双特异性抗体 | XmAb-808(B7-H3xCD28) | Xencor, Inc. | I期 |
| 单克隆抗体 | Enoblituzumab | MacroGenics, Inc. | II期 |
| 单克隆抗体 | IBI-129 | Innovent Biologics (Suzhou) Co. Ltd. | I/II期 |
| 融合蛋白 | IBB0979 (B7-H3xIL-10) | 盛禾生物(Sunho (China) Biopharmaceutical) | I/II期 |
此外,目前临床上还有两款Y-mAbs Therapeutics开发的抗体偶联核素131I-omburtamab和Monoclonal antibody 8H9 I-124,二者分别处于申请上市阶段和临床II期。
4、缔码B7-H3相关产品与服务,助力B7-H3生物疗法开发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供B7-H3靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务包括多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速B7-H3生物疗法的开发,缔码还制备了B7-H3靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们目前已筛选出80+ DH17先导分子,其中有近50个验证了人猴蛋白交叉反应,客户第二天可以拿到分子进行功能评估验证;针对部分分子,我们也正在进行ADC内吞活性及杀伤验证,具体数据欢迎垂询。
- B7-H3蛋白&抗体
| 产品类型 | 货号 | 产品名称 |
| 蛋白 | PME-C100018 | Cynomolgus B7-H3 Protein, His Tag |
| PME-M100008 | Mouse B7-H3 Protein, hFc Tag | |
| PME100012 | Human B7-H3 Protein, mFc-His Tag | |
| PME100755 | Human B7-H3 Protein, mFc Tag | |
| 抗体 | DME100053 | Anti-B7-H3 antibody(DM53); Rabbit mAb |
| DME100053B | Biotinylated Anti-B7-H3 antibody(DM53); Rabbit mAb | |
| 参照抗体 | BME100181 | Anti-B7-H3 (TAA06 biosimilar) mAb |
| BME100010 | Anti-B7-H3 (enoblituzumab biosimilar) mAb | |
| BME100010B | Biotinylated Anti-B7-H3 (enoblituzumab biosimilar) mAb | |
| BME100181B | Biotinylated Anti-B7-H3 (TAA06 biosimilar) mAb |
- B7-H3先导分子研究进度

参考文献:
[1] Ni, L. & Dong, C. New B7 family checkpoints in human cancers. Mol. Cancer Ther. 16, 1203–1211.
[2] Chapoval AI, Ni J, Lau JS, Wilcox RA, Flies DB, Liu D, Dong H, Sica GL, Zhu G, Tamada K, Chen L. B7-H3: a costimulatory molecule for T cell activation and IFN-gamma production. Nat Immunol. 2001 Mar;2(3):269-74.
[3] Sun M, Richards S, Prasad DV, Mai XM, Rudensky A, Dong C. Characterization of mouse and human B7-H3 genes. J Immunol. 2002 Jun 15;168(12):6294-7.
[4] Kontos F, Michelakos T, Kurokawa T, Sadagopan A, Schwab JH, Ferrone CR, Ferrone S. B7-H3: An Attractive Target for Antibody-based Immunotherapy. Clin Cancer Res. 2021 Mar 1;27(5):1227-1235.
[5] Zhang G, Hou J, Shi J, Yu G, Lu B, Zhang X. Soluble CD276 (B7-H3) is released from monocytes, dendritic cells and activated T cells and is detectable in normal human serum. Immunology. 2008;123:538–46.
[6] Sun J, Fu F, Gu W, Yan R, Zhang G, Shen Z, Zhou Y, Wang H, Shen B, Zhang X. Origination of new immunological functions in the costimulatory molecule B7-H3: the role of exon duplication in evolution of the immune system. PLoS One. 2011;6(9):e24751.
[7] Ni L, Dong C. New B7 Family Checkpoints in Human Cancers. Mol Cancer Ther. 2017 Jul;16(7):1203-1211.
[8] Picarda E, Ohaegbulam KC, Zang X. Molecular Pathways: Targeting B7-H3 (CD276) for Human Cancer Immunotherapy. Clin Cancer Res. 2016 Jul 15;22(14):3425-3431.
[9] Vigdorovich V, Ramagopal UA, Lázár-Molnár E, Sylvestre E, Lee JS, Hofmeyer KA, Zang X, Nathenson SG, Almo SC. Structure and T cell inhibition properties of B7 family member, B7-H3. Structure. 2013 May 7;21(5):707-17.
[10] Han S, Wang Y, Shi X, Zong L, Liu L, Zhang J, Qian Q, Jin J, Ma Y, Cui B, Yang X, Kong B, Zhang Y. Negative roles of B7-H3 and B7-H4 in the microenvironment of cervical cancer. Exp Cell Res. 2018 Oct 1;371(1):222-230.
[11] Getu AA, Tigabu A, Zhou M, Lu J, Fodstad Ø, Tan M. New frontiers in immune checkpoint B7-H3 (CD276) research and drug development. Mol Cancer. 2023 Mar 2;22(1):43.
[12] Ding M, Liao H, Zhou N, Yang Y, Guan S, Chen L. B7-H3-Induced Signaling in Lung Adenocarcinoma Cell Lines with Divergent Epidermal Growth Factor Receptor Mutation Patterns. Biomed Res Int. 2020 Dec 24;2020:8824805.


