从市场情报提供商Future Market Insights, Inc.(FMI)今年9月12日发布的博客中了解到,全球系统性红斑狼疮 (SLE) 药物市场规模增长明显,而且增速令人惊讶。FMI预测SLE药物市场在未来几年更将出现强劲扩张。2020年,该市场价值为 1833亿美元,预计到2032年将达到惊人的3291.8 亿美元,复合年增长率(CAGR)为5%。报告还表明SLE市场的增长可归因于生物制剂和靶向疗法的进步、对疾病机制的深入了解、临床试验和研究计划和政府针对罕见病治疗的计划等。那究竟有哪些药企布局了SLE药物呢?在此之前,我们先简单了解下SLE的背景。
1、SLE概述
系统性红斑狼疮(SLE)是一种累及多系统多器官的自身免疫性疾病,其特征是产生针对细胞核成分的自身抗体,从而导致多样化的临床表现。尽管SLE的确切病理仍不清楚,但它的发病机制较为复杂,涉及环境因素、遗传、表观遗传、免疫等多因素的相互作用。其中,免疫调节障碍是主要的发病机制。

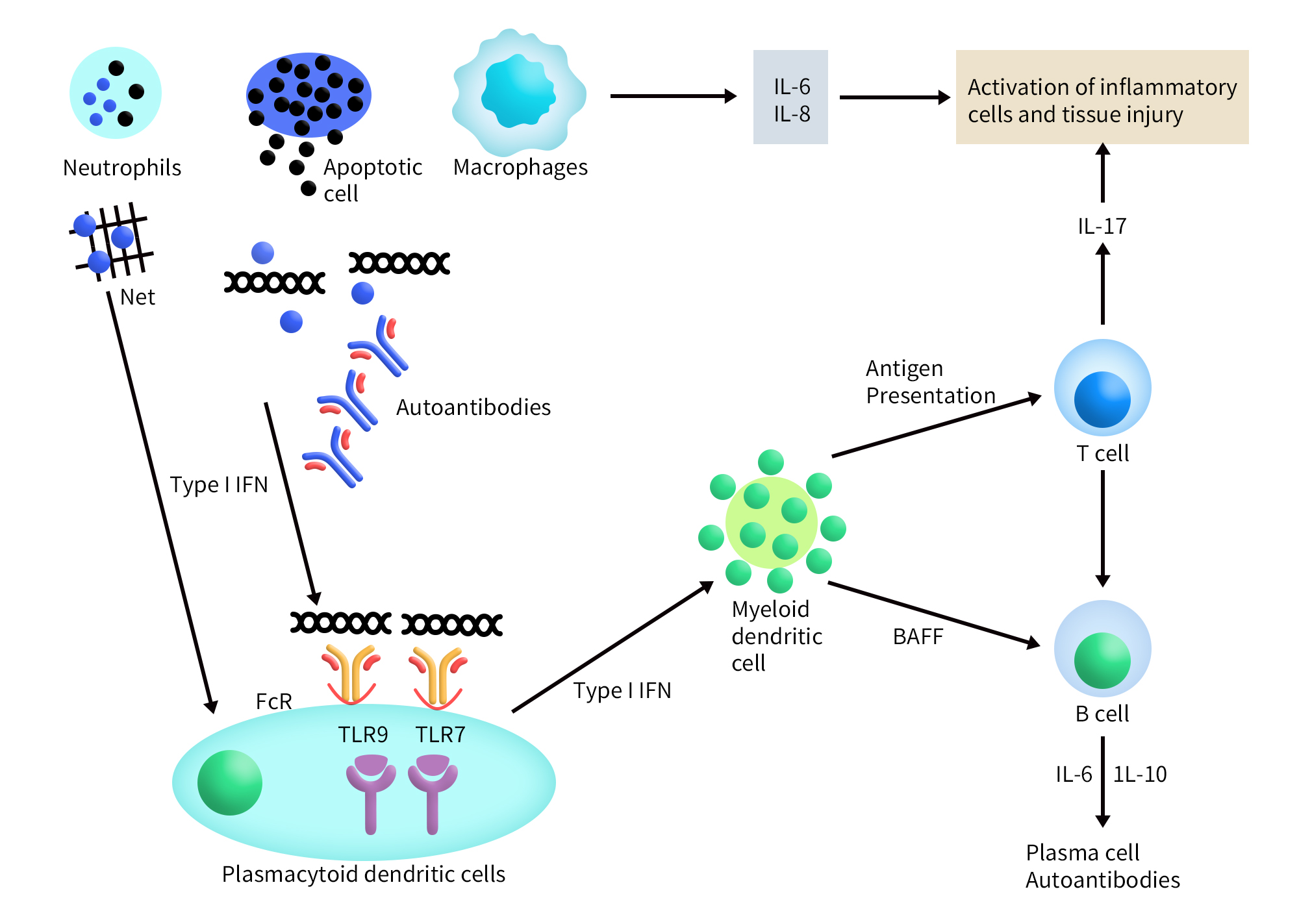
Figure 1. Immunobiology of systemic lupus erythematosus [1]
SLE的免疫调节障碍主要涉及微环境中先天/适应性免疫因素与细胞之间的相互作用,并y诱发免疫反应。其中,中性粒细胞是一个非常重要的触发因素。在SLE中,由于活性氧 (ROS) 水平高,IL-18受体增强会触发中性粒细胞失调[2]。中性粒细胞胞外陷阱(NET)增强,这与狼疮中B细胞分泌IgG2增多有关[3]。中性粒细胞脱颗粒会增加促炎细胞因子 (IFN-ϒ) 的分泌,而这可加剧狼疮[4]。先天免疫受体(如Toll样受体TLRs)具有识别病原体相关分子模式 (PAMP),可通过关联先天和适应性免疫反应来诱导免疫系统激活。细菌或真菌PAMPs的TLR1、TLR2、TLR4、TLR5 和TLR6位于细胞表面,而核酸(单链/双链RNA或DNA)的 TLR3、TLR7、TLR8和TLR9位于内体膜上[5]。其中,TLR7和TLR9与SLE发病机制密切相关,因为含有自身核酸成分的循环免疫复合物激活浆细胞样树突状细胞 (pDC)后,TLR7和TLR9介导其产生IFNα [6]。TLR7能够调节生发中心的滤泡外B细胞反应,从而增强自身抗体的产生,而TLR9能够限制TLR7的刺激活性,表明其在狼疮病因中具有保护作用[7]。血小板含有功能性TLR7,该受体负责血小板的激活,从而导致血小板-白细胞聚集,可能参与病毒攻击后启动免疫系统 [8]。研究还发现,其他TLRs,如TLR2和TLR4,在SLE患者的唾液中也有高表达,然而,在狼疮患者中,慢性牙周炎的存在表明它们的表达较低[9]。
2、全球SLE药物研究进展
不完全统计,针对适应症SLE,目前全球共有478款药物。其中,临床前药物数量最多,共计93款;已经批准上市的药物数量为72款;临床2期和临床1期分别有64款和63款;处于无进展和已终止状态的药物数量共计102款。综合而言,该制药行业赛道在研发阶段药物数量较多,且已有大量药物取得批准上市,具有较高的发展潜力。
从布局的药企方面分析,大型制药公司如Pfizer Inc.、Novartis AG、Bristol Myers Squibb Co.等,虽然拥有较多的药物进入临床阶段,但批准上市的药物数量相对较少。相比之下,中小型公司如江苏恒瑞医药、Amgen, Inc.、AstraZeneca PLC等,虽然进入临床阶段的药物数量较少,但批准上市的药物数量丰富。从靶点角度而言,涉及CD19的临床药物最多,其次是BTK和TYK2。这里主要从靶点维度展示临床药物及布局企业。
2.1 靶向CD19的SLE药物
目前全球SLE药物涉及CD19靶点的已上市和临床阶段药物共计49款,其中,有近一半(23款)处于临床1期;已批准上市和正在申请上市的共计6款;处于临床2期和3期的共有6款。在这些药物中,靶向CD19单靶点药物数量最多(30款);其次是BCMA&CD19双靶点药物,有7款(点击了解更多BCMA在自身免疫性疾病中的研究进展>>);靶向CD19&CD20、4-1BB&CD19、CD19&CD3双靶点的药物数量都为2;靶向CD19&IL15R、CD19&CD32B、CD19&IL-2Rβ及CD19&PD-1双靶点的要数量各一款;此外,还有两款药分别靶向CD19&CD2&CD3和CD19&CD28&CD3三靶点。



2.2 靶向Toll样受体TLR的SLE药物
目前全球范围内,靶向Toll样受体TLR的SLE在研药物共计9款,其中靶向TLR7&TLR8双靶点的药物有5款;药物类型涵盖重组蛋白(1款)、小分子化药(7款)和单克隆抗体(1款)。目前临床研究进展最快的是Delta Crystallon BV的Recombinant alpha Crystallin B、默克的Enpatoran和Bristol Myers Squibb的Afimetoran,均处于临床2期。
Recombinant alpha Crystallin B也称为DC-TAB或SER-101,是一种重组人类HspB5,靶向的是TLR2靶点,能够在髓系细胞群中诱导持久的致耐受性途径,目前正由Serenity Bioworks推进临床应用,用于治疗狼疮性肾炎。enpatoran是由德国默克开发的TLR7/8拮抗剂,已证明其可特异性抑制多种配体激活TLR7/TLR8。已知TLR7和TLR8的激活可刺激抗体产生、干扰素(IFN)和其它细胞因子的分泌、细胞成熟以及其它保护性宿主机制的激活。抑制其激活可降低SLE和CLE患者的疾病活动度、狼疮急性发作严重程度以及糖皮质激素需求。默克正在针对enpatoran开展一项2期临床研究,旨在评估该药在皮肤型红斑狼疮和系统性红斑狼疮患者中的有效性和安全性。此外,BMS开发的afimetoran也是TLR7/8拮抗剂,作用机理与enpatoran一致,目前也处于临床II期。

2.3 靶向BTK的SLE药物
布鲁顿酪氨酸激酶(BTK)是B细胞受体信号通路中的关键激酶,参与调节B细胞成熟、增殖、分化、凋亡、细胞迁移等过程。BTK异常活化会导致B细胞受体信号通路过度活跃,与B细胞恶性肿瘤的发生、发展密切相关。基于此,BTK抑制剂在血液瘤领域取得了巨大的成功。由于自免疾病通常涉及自身反应性B细胞的异常选择和激活以及随后的自身抗体产生,这使得BTK成为自身免疫性疾病的一个有潜力的治疗靶点。目前,针对SLE适应症,全球在研的靶向BTK药物共计14款,其中13款是小分子化药,1款是蛋白水解靶向嵌合体。小分子化药目前已有2款上市,1款处于临床3期,5款处于临床2期;蛋白水解靶向嵌合体目前还处于临床前研究阶段。

除了以上靶点,针对SLE适应症,也有不少小众靶点,比如CD40L、CD74、DHODH、S1PR1等,这里展示了部分仅针对SLE适应症临床阶段的药物及在研机构。

3、缔码生物现货先导分子助力自免药物研发
缔码生物是一家成立于2018年的生物技术公司,专注于为生物制药公司提供产品和服务,已开发出针对400+个热门药靶的5,000+现货先导抗体分子,所有抗体都具备独特的抗体序列及验证数据。未来几年,缔码将开发出针对所有可成药靶点的现货抗体分子,加快生物制药公司抗体药临床前开发的步伐。
缔码生物拥有多个自主研发的技术平台,包括:
- DiMPro™膜蛋白表达平台:利用哺乳动物细胞表达系统和Nanodisc先进技术制备和纯化各种全长穿膜蛋白,包括多个GPCR蛋白和离子通道。
- DIMA mAbs单B细胞单克隆抗体开发平台:已完成400+个可成药靶点的先导抗体开发,获得5,000+个抗体分子的IgG序列信息及验证数据。
- DiLibrary™哺乳动物细胞展示为基础的抗体工程平台:适用于抗体人源化、亲和力成熟等改造,筛选出的抗体具有更高的可成药性及亲和力。
- DiTag™ ADC抗体检测试剂:有效评估ADC抗体的效率。
参考文献:
[1] Akhil, A., Bansal, R., Anupam, K. et al. Systemic lupus erythematosus: latest insight into etiopathogenesis. Rheumatol Int 43, 1381–1393 (2023).
[2] Ma J et al. Elevated interleukin-18 receptor accessory protein mediates enhancement in reactive oxygen species production in neutrophils of systemic lupus erythematosus patients. Cells 10(5):964
[3] Bertelli R et al. Neutrophil extracellular traps in systemic lupus erythematosus stimulate IgG2 production from B lymphocytes. Front Med, 2021, 8:635436.
[4] Liu Y, Kaplan MJ. Neutrophil dysregulation in the pathogenesis of systemic lupus erythematosus. Rheum Dis Clin, 2021, 47(3):317–333.
[5] Pan L et al. Immunological pathogenesis and treatment of systemic lupus erythematosus. World J Pediatr, 2020, 16(1):19–30.
[6] Nasser N, Kurban M, Abbas O. Plasmacytoid dendritic cells and type I interferons in flares of systemic lupus erythematosus triggered by COVID-19. Rheumatol Int, 2021, 41(5):1019–1020.
[7] Fillatreau S, Manfroi B, Dörner T. Toll-like receptor signalling in B cells during systemic lupus erythematosus. Nat Rev Rheumatol, 2021, 17(2):98–108
[8] Brilland B, Scherlinger M, Khoryati L, et al. Platelets and IgE: shaping the innate immune response in systemic lupus erythematosus. Clin Rev Allerg Immunol, 2019, 58:1–19.
[9] Marques CP et al. Expression of Toll-like receptors 2 and 4 in the saliva of patients with systemic lupus erythematosus and chronic periodontitis. Clin Rheumatol, 2021, 40(7):2727–2734.