2024年3月,艾伯维AbbVie宣布将终止与MacroGenics合作开发IMGC936,原因是其临床I期试验结果没有达到预期内的安全性和有效性目标。IMGC936是一款靶向ADAM9的抗体偶联药物(ADC),此前是由ImmunoGen和MacroGenics合作开发,二者各享有IMGC936的50%权益。去年11月,AbbVie以101亿美元的价格收购了ImmunoGen。尽管IMGC936的临床开发终止了,但对于ADAM9 ADC药物的开发MacroGenics并没有放弃,目前MacroGenics正在继续开发一种以ADAM9为靶点的ADC-MGC028,并计划在今年年底前申请批准进行人体试验。ADAM9究竟有何魔力让MacroGenics如此锲而不舍呢?当前布局的药企又有哪些?
1、ADAMs家族
ADAM9(A distegrinin and a metalloprotease 9),也称为MDC9或 meltrin-γ,是去整合素和金属蛋白酶(ADAMs) 家族一员,ADAMs属于锌蛋白超家族。迄今为止,在哺乳动物中已鉴定出约40个ADAMs成员,其中在人类中表达的有22个[1],包括ADAM2、ADAM5、ADAM7、ADAM8、ADAM9、ADAM10、ADAM11、ADAM12、ADAM15、ADAM17、ADAM18、ADAM19、ADAM20、ADAM21(ADAM31)、ADAM22、ADAM23、ADAM27、ADAM28、ADAM29、ADAM30、ADAM32和ADAM33 [2]。如Figure 1所示,ADAMs成员的蛋白结构大致相同,均包含信号肽、前结构域、金属蛋白酶结构域、解整合素结构域、富含半胱氨酸结构域、跨膜结构域及细胞质尾。除了DAM10和ADAM17之外,其他ADAMs家族成员在富含半胱氨酸和跨膜结构域之间还具有表皮生长因子(EGF)样结构域。在金属蛋白酶结构域中,决定ADAM蛋白酶活性的共识序列是HEXGHXXGXXHD,其中组氨酸结合锌离子和谷氨酸有助于催化[3]。值得注意的是,并不是所有ADAMs成员的金属蛋白酶结构域中都含有共识序列,比如ADAM11、ADAM22和ADAM23,它们主要是通过与其他蛋白质结合直接参与细胞-细胞信号传导的非活性ADAMs。与胞外结构域相比,ADAMs的胞质结构域相对较短,它包含了各种胞内信号转导蛋白的结合位点[4]。
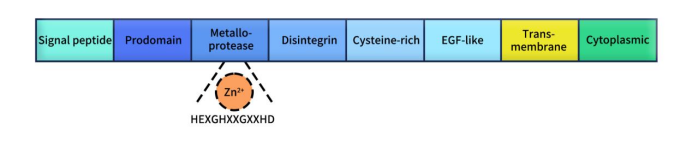
Figure 1. The typical structure of ADAMs [5]
2、ADAM9结构与功能
ADAM9既存在于小鼠中,也存在于人类中,于1996年在乳腺癌中首次发现,其蛋白结构为典型的ADAMs结构,包含一个N端信号肽(1-29aa)、一个前结构域(30-205aa)、一个金属螯合水解酶结构域(206–412aa)、一个Disintegrin结构域(413-503aa)、一个Cys-rich结构域(504-643aa)、一个EGF-like结构域(644-698aa)、一个跨膜结构域(699-718aa)和一个胞质结构域(719-819aa)组成。N端信号肽可引导ADAM9运输至细胞表面,而ADAM9 的跨膜结构域可将其锚定在细胞膜上;ADAM以酶原形式生物合成,该结构域可作为后由弗林样前蛋白转化酶 (PC)切割;ADAM9 的金属蛋白酶结构域内含有金属蛋白酶催化锌结合基序的共识序列,该结构域具有催化活性;解整合素结构域可作为配体与多种β1肾整合素相互作用,因此可以调节与细胞外基质(ECM)关键成分的附着;作为配体与多种β1肾整合素相互作用,因此可以调节与ECM关键成分的附着;EGF样结构域的功能尚未完全了解;ADAM9 的胞质域含有 4 个潜在的SH3结合位点,在调节其催化活性方面发挥着作用。

Figure 2. The characteristics of ADAM9 structure [6]
如Figure 2所示,ADAM9存在两个可变剪接体,表达的蛋白分别是跨膜形式(ADAM9-L)和可溶形式(ADAM9-S)。ADAM9-S是一种分泌蛋白,通过切除ADAM9 mRNA中的外显子12而缺乏跨膜和胞质结构域,并含有8个ADAM9-L中不存在的独特氨基酸(LSLKFHAPF)。ADAM9作为蛋白酶,可在在细胞表面剪切许多底物,包括细胞粘附分子和生长因子,这对正常细胞黏附和迁移至关重要。此外,ADAM9还参与细胞的迁移和增殖,促进细胞侵袭和转移,并与细胞融合和细胞凋亡等过程相关。这些功能的紊乱与多种疾病的发展密切相关。
3、ADAM9与肿瘤
ADAM9广泛表达于人体组织中,包括肺、结肠、肾脏、血管平滑肌、神经系统、生殖系统等,而且在病理状态下表达量增加。ADAM9在多种细胞类型中表达,包括单核细胞[、巨噬细胞、中性粒细胞、角质形成细胞和成纤维细胞。ADAM9参与肝癌、乳腺癌、肺癌、胃癌、肾癌、前列腺癌等多种恶性肿瘤增殖、侵袭转移、血管生成甚至免疫逃逸中发挥重要作用。
在肺癌中,ADAM9在其进展和转移中起着重要作用,而且ADAM9过表达会缩短总生存期。转移是肺癌相关死亡的主要原因,近50%的晚期肺癌患者出现脑转移。Shintani等人首次报道过表达ADAM9可促进肿瘤细胞与血管内皮细胞的粘附,这也表明ADAM9在转移过程中的重要性[7]。有研究表明,ADAM9通过基于组织型纤溶酶原激活物(tPA)的途径促进CDCP1激活肺癌转移到大脑[8]。Fritzsche等研究表明,ADAM9 mRNA和蛋白过表达与前列腺癌无复发生存率低相关。免疫组化结果显示,超过60%的复发性前列腺肿瘤ADAM9蛋白表达升高 [9] [10]。在乳腺癌中,ADAM9的表达较正常组织上调。ADAM9还通过促进肿瘤外渗和迁移能力促进疾病进展。
4、ADAM9靶向药临床研究进展
基于ADAM9在肿瘤中的重要作用,结合其差异化表达的特性,ADAM9已成为有一引力的靶点。目前靶向AMAM9的药物类型均是ADC,但进入临床的仅有一款IMGC-936,AEX-6003和MGC-028还处于临床前阶段。
- IMGC-936
IMGC-936是由MacroGenics原研,后与ImmunoGen(现已被艾伯维收购)合作开发的一款ADAM9 ADC药物。IMGC-936由三部分组成:高亲和力的人源化单克隆抗体、美登木素生物碱微管抑制剂载荷和稳定的三肽接头,DAR为2。临床前数据表明其可以抑制多个肿瘤CDX模型进展,而且在食蟹猴毒理试验中展现出良好的耐受性。目前已完成针对晚期恶性实体瘤的I/II期临床试验(NCT04622774),这是一项IMGC936在晚期实体瘤患者中的 1/2 期、首次人体、开放标签、剂量递增和扩展研究。但由于该试验结果没有达到预期内的安全性和有效性目标,艾伯维已终止与MacroGenics合作开发IMGC936。目前关于IMGC936临床试验是否还会继续推进现在还是未知数。
- MGC-028
MGC028是由MacroGenics开发的第二代ADAM9 ADC药物,利用Synaffix公司可裂解linker,高极性间隔子提高稳定性,毒素采用依喜替康衍生物,DAR4。在2024 AACR会议上,MacroGenics公布了MGC028的临床前数据。数据表明,MGC028可以抑制多个PDX肿瘤模型进展。MacroGenics计划在今年年底前申请批准进行人体试验。
- AEX-6003
AEX-6003是由ImmunoGen开发的一款ADAM9 ADC药物,其连接子为可裂解连接子SPDB,毒素是Maytansinoid DM4,目前处于临床前阶段,对外公布的药物信息很少,需要持续跟进。
5、缔码ADAM9相关产品助力药物研发
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。缔码现可提供ADAM9靶点全系列产品与服务。产品包括活性蛋白、参照抗体和流式验证单克隆抗体;服务涵盖多种属蛋白抗体定制服务、抗体人源化和亲和力成熟服务。此外,为加速ADAM9生物疗法的开发,缔码还制备了ADAM9靶点单B细胞种子库,最快28天可获得先导抗体分子;同时,我们目前已筛选出有42个ADAM9先导分子,其中人猴交叉的有22个,人鼠交叉的有12个,猴鼠交叉的有11个,客户第二天可以拿到分子进行功能评估验证;针对部分分子,我们也正在进行ADC内吞活性及杀伤验证,具体数据欢迎垂询。
- ADAM9蛋白&抗体&细胞株&CDX切片
| 产品类型 | 产品货号 | 产品名称 |
| 重组蛋白 | PME100901 | Human ADAM9 Protein, His Tag |
| PME100128 | Human ADAM9 Protein, hFc Tag | |
| PME-M100006 | Mouse ADAM9 Protein, His Tag | |
| PME-C100012 | Cynomolgus ADAM9 Protein, His Tag | |
| 重组单克隆抗体 | DME100192 | Anti-ADAM9 antibody(DM192); Rabbit mAb |
| DMC100832 | Anti-ADAM9 antibody(45G10), IgG1 Chimeric mAb | |
| 参照抗体 | BME100230 | Anti-ADAM9(izeltabart biosimilar) mAb |
| BME100064 | Anti-ADAM9 (biosimilar) mAb | |
| 生物素标记抗体 | BME100230B | Biotinylated Anti-ADAM9(izeltabart biosimilar) mAb |
| BME100064B | Biotinylated Anti-ADAM9 (biosimilar) mAb | |
| DME100192B | Biotinylated Anti-ADAM9 antibody(DM192); Rabbit mAb | |
| CDX切片 | SLI100021 | M-NSG AGS DiSliceX™ SlideSet |
| SLI100014 | M-NSG SNU-5 DiSliceX™ SlideSet | |
| SLI100005 | Balb/C nu A431 DiSliceX™ SlideSet | |
| SLI100004 | Balb/C nu HuH7 DiSliceX™ SlideSet |
- ADAM9先导分子研究进度

参考文献:
[1]Weber S, Saftig P. Ectodomain shedding and ADAMs in development. Development. 2012 Oct;139(20):3693-709.
[2]Hsia, H. E., Tüshaus, J., Brummer, T., et al. Functions of ‘A disintegrin and metalloproteases (ADAMs)’ in the mammalian nervous system. Cellular and molecular life sciences : CMLS, 2019, 76(16), 3055–3081.
[3]Stocker W, Grams F, Baumann U, Reinemer P, Gomis-Ruth FX, McKay DB, Bode W. The metzincins—topological and sequential relations between the astacins, adamalysins, serralysins, and matrixins (collagenases) define a superfamily of zinc-peptidases. Protein Sci. 1995;4(5):823–840.
[4]Wolfsberg TG, White JM. ADAMs in fertilization and development. Dev Biol. 1996;180(2):389–401.
[5]Hsia, H. E., Tüshaus, J., Brummer, T., Zheng, Y., Scilabra, S. D., & Lichtenthaler, S. F. (2019). Functions of ‘A disintegrin and metalloproteases (ADAMs)’ in the mammalian nervous system. Cellular and molecular life sciences : CMLS, 76(16), 3055–3081.
[6]Chou, C. W., Huang, Y. K., Kuo, T. T., et al. An Overview of ADAM9: Structure, Activation, and Regulation in Human Diseases. International journal of molecular sciences, 2020, 21(20), 7790.
[7]Shintani Y., Higashiyama S., Ohta M., et al. Overexpression of ADAM9 in Non-Small Cell Lung Cancer Correlates with Brain Metastasis. Cancer Res. 2004;64:4190–4196.
[8]Lin C.Y., Chen H.J., Huang C.C., et al. ADAM9 promotes lung cancer metastases to brain by a plasminogen activator-based pathway. Cancer Res. 2014;74:5229–5243.
[9]ritzsche F.R., Jung M., Tölle A., et al. ADAM9 expression is a significant and independent prognostic marker of PSA relapse in prostate cancer. Eur. Urol. 2008;54:1097–1106.
Hua Y., Liang C., Miao C., et al. MicroRNA-126 inhibits proliferation and metastasis in prostate cancer via regulation of ADAM9. Oncol. Lett. 2018;15:9051–9060.


