2023年11月30日,Inipharm,一家专注于发现和开发严重肝病疗法的生物制药公司,宣布已开始对其口服制剂INI-822进行临床一期研究。INI-822是第一个进入临床开发的HSD17B13小分子抑制剂,也是Inipharm开发的第一个临床候选药物,主要用于治疗纤维化肝病,包括非酒精性脂肪性肝炎(NASH)。那HSD17B13究竟有何魅力让Inipharm将其作为首个候选药物?目前还有哪些药企对其进行了管线布局?
1、HSD17B13结构与分布
羟基类固醇17β-脱氢酶13(HSD17B13,又称为SCDR9 、SDR16C3)属于HSD17B家族,是一种脂滴(LD)酶。目前已确认同属HSD17B家族的成员有15个,其中序列相似性最高(85%)的是HSD17B11蛋白。在这些成员中,HSD17B1、HSD17B2、HSD17B3、HSD17B5、HSD17B6与性激素的激活或失活有关,HSD17B4、HSD17B7、HSD17B8、HSD17B9、HSD17B10、HSD17B11、HSD17B12、HSD17B14和HSD17B15参与脂肪酸代谢、胆固醇生物合成和胆汁酸产生。
HSD17B13基因最早是于2007年由Liu S等人从人肝脏cDNA文库中克隆出来[1],最初命名为SCDR9。人类HSD17B13基因长约17 kb,位于染色体4q22.1,具有8个外显子和7个内含子。它通过选择性剪接编码 9 种不同的蛋白质亚型,分子量在22至33 kDa之间。HSD17B13 蛋白具有所有SCDR家族成员中都存在的两个保守基序。一个是与NAD(P) (H)结合相关的 TGXGXXXG 基序,另一个是对其催化活性至关重要的YXXXK 基序(x 表示任何氨基酸残基)。
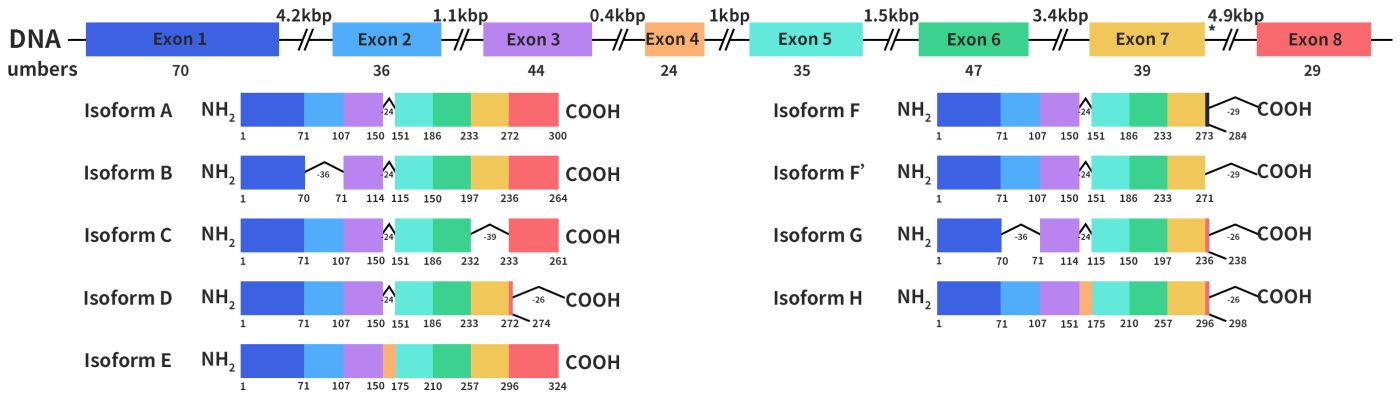
Figure 1. the structures of HSD17B13 gene and protein [1]
研究表明,人类HSD17B13是一种肝细胞特异性脂滴( LD )相关蛋白,在肝脏中表达最丰富,在卵巢、骨髓、肾脏、脑、肺、骨骼肌、膀胱和睾丸中表达量较低。HSD17B13主要位于肝脏中 LD 的包膜上,其N端序列 1–28aa是其LD定位所必需的 [2]。HSD17B13在肝脏脂滴生物发生、生长和降解的调节中发挥重要作用。一项全基因组关联研究发现了HSD17B13基因中的一种剪接变异 (rs72613567:TA),与脂肪肝患者丙氨酸氨基转移酶 (ALT) 和天冬氨酸氨基转移酶 (AST) 水平降低有关,表现出炎症和肝损伤减少[3]。
2、HSD17B13作用机制
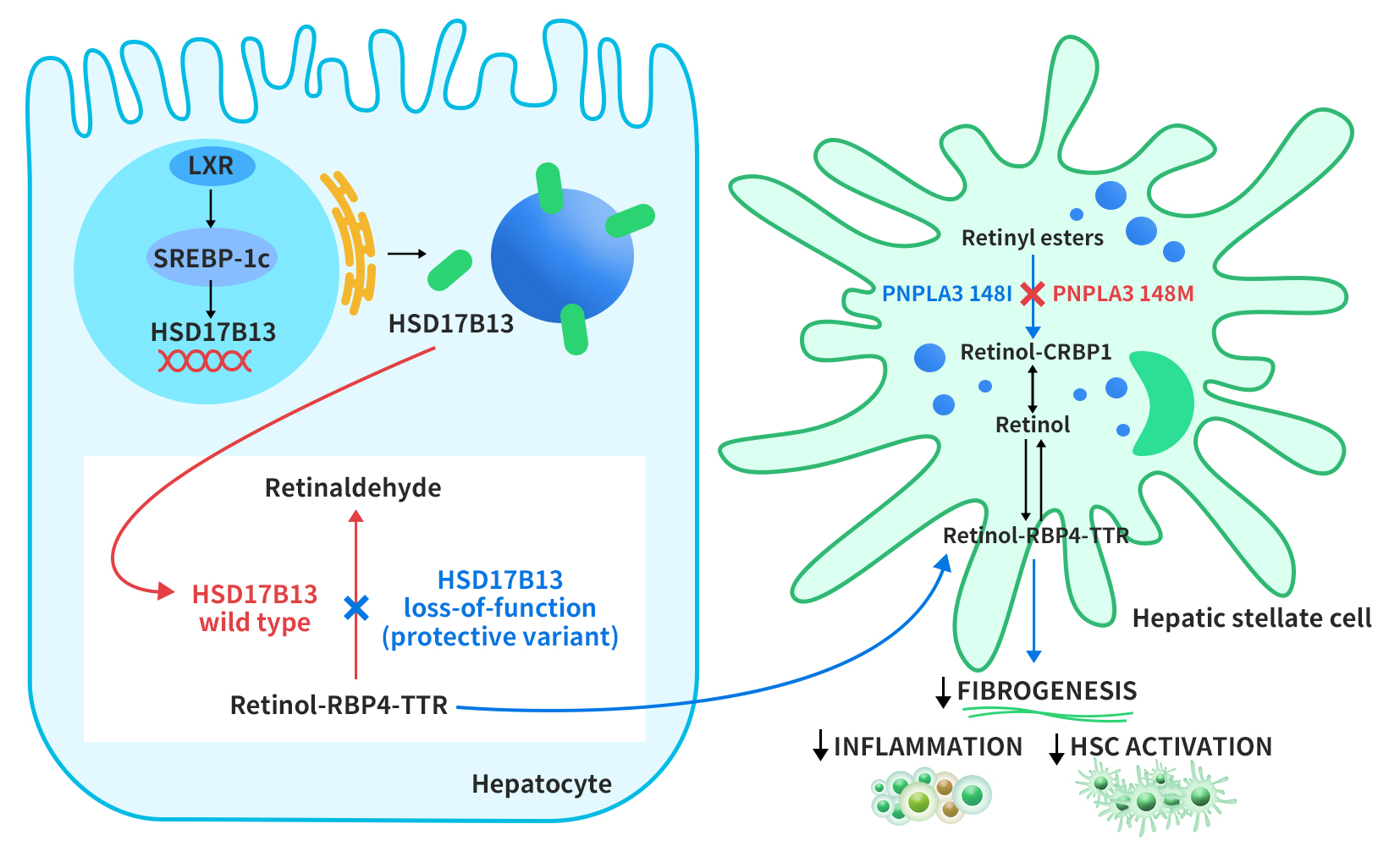
迄今为止,人们对 HSD17B13 表达调控机制知之甚少。2017年,Su等人的研究表明,肝脏x受体-α(LXR-α)(一种调节脂质代谢相关基因表达的核受体)可通过甾醇调节结合蛋白-1c(SREBP-1c)诱导HSD17B13表达。然后HSD17B13从内质网靶向脂滴。野生型HSD17B13催化视黄醇转化为视黄醛。HSD17B13的遗传多态性导致这种酶活性的丧失,从而加快RBP4-TTR(视黄醇结合蛋白-甲状腺素转运蛋白)从肝细胞中转运出去。PNPLA3位于脂滴上,对肝星状细胞 (HSC) 中的视黄酯具有水解酶活性。I148M突变导致视黄酯酶活性丧失,视黄醇保留在 HSC 中。类视黄醇在肝脏免疫调节和抑制HSC 介导的纤维发生中发挥重要作用[4]。
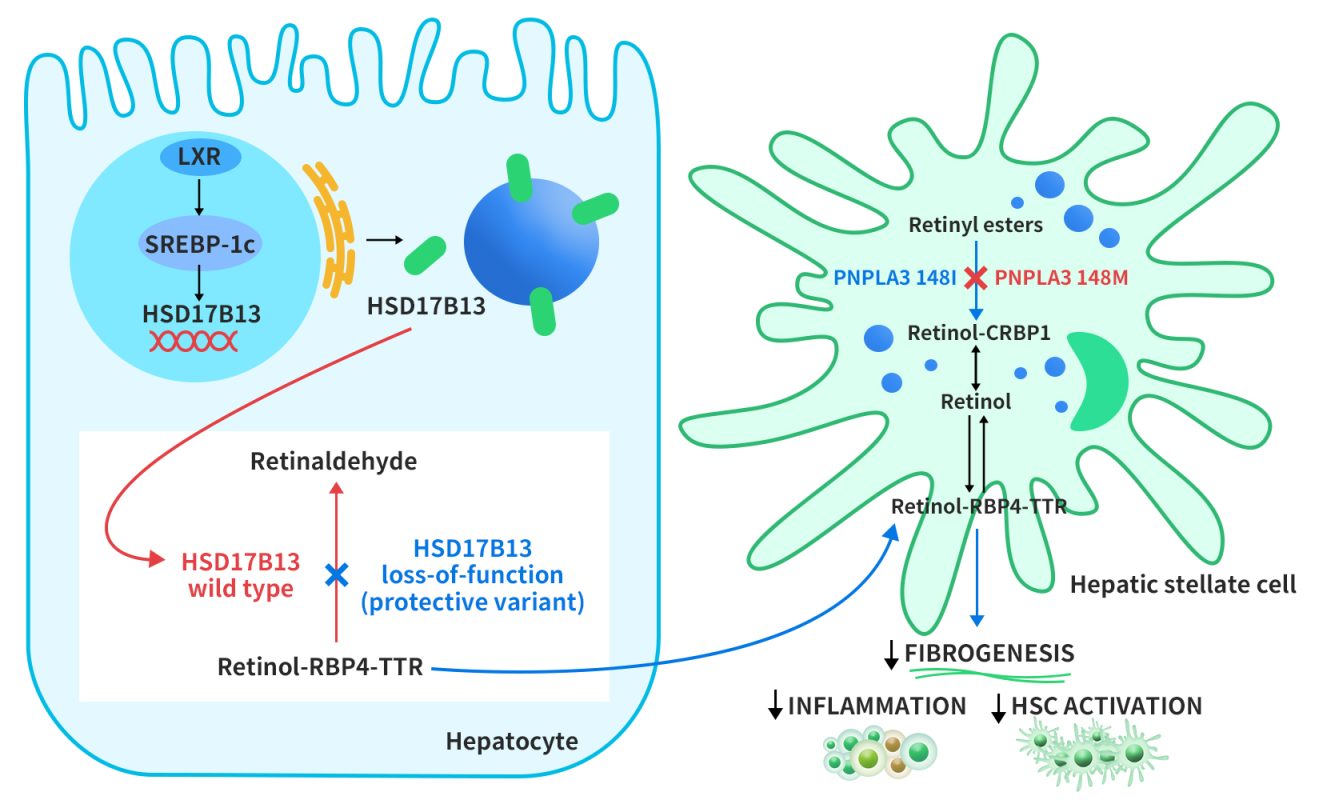
Figure 2. Proposed role of HSD17B13 in modulating disease progression in NAFLD [4]
3、靶向HSD17B13治疗NASH的治疗策略
尽管目前HSD17B13在肝脏脂质代谢中的生物学作用和潜在机制仍不完全清楚。但基于人类遗传学研究和一些临床前研究结果,HSD17B13已经作为NAFLD的潜在治疗靶点,且有部分治疗方法已获批临床试验。现阶段,针对该靶点的治疗方案主要集中在两方面,一方面是RNA干扰 (RNAi) 治疗,另一方面是小分子抑制剂,目前均未有治疗方法获批上市。
3.1 RNAi疗法
使用RNA干扰(RNAi)治疗方式阻断HSD17B13表达是一种自然细胞过程,其中双链RNA抑制相同序列mRNA的翻译或诱导序列特异性降解,从而导致基因沉默。
ALN-HSD
ALN-HSD,由Alnylam Pharmaceuticals开发,是一种N-乙酰半乳糖胺 (GalNAc)缀合siRNA,给药方式是皮下注射,目前处于临床I期。2023年EASL大会上,美国弗吉尼亚联邦大学Sanyal A在口头报告中介绍了ALN-HSD在健康成人和非酒精性脂肪性肝炎患者中的I 期研究(NCT04565717)。研究结果表明ALN-HSD在体内具有良好的安全性和耐受性;与安慰剂组相比,ALN-HSD可导致肝脏HSD17β13 mRNA表达明显下降,肝酶的缓解和NAS评分的降低。
ARO-HSD
ARO-HSD,由Arrowhead Pharmaceuticals开发,也是一种N-乙酰半乳糖胺 (GalNAc)缀合siRNA。ARO-HSD由双链RNAi触发器组成,用于选择性靶向肝细胞中的HSD17B13 mRNA,达到降低HSD17B13蛋白表达的作用。Arrowhead于2019年启动I期临床试验(NCT04202354)。 2021年6月23日,Arrowhead Pharmaceuticals在EASL国际肝脏大会上公布了NCT04202354的积极中期结果。结果表明,ARO-HSD能显著下调肝脏HSD17B13 mRNA和蛋白质水平,从而导致肝细胞损伤标志物血清丙氨酸转氨酶(ALT)水平降低。ARO-HSD也是首个实现肝HSD17B13的mRNA和蛋白降低的药物。
2021年11月,Arrowhead与GSK签署了独家开发许可协议。GSK获得了在除大中华区以外的所有地区开发和商业化GSK4532990(原名:ARO-HSD)的独家许可,大中华区的权利由Arrowhead公司保留。
3.2 小分子抑制剂
小分子抑制剂由于分子量小,可以轻松渗透细胞膜以靶向细胞内存在的蛋白质。针对HSD17B13 的小分子抑制剂在过去几年中一直受到制药行业的关注。但已上临床的只有INI-822。INI-822是由Inipharm开发的一款靶向HSD17B13的小分子抑制剂。目前正在临床开展针对非酒精性脂肪性肝炎适应症的I期试验(NCT05945537)。NCT05945537是一项随机、双盲、安慰剂对照、单次和多次剂量递增研究,旨在评估该药物在患有NASH或疑似NASH 和健康受试者中的安全性、耐受性和药代动力学。目前正处于招募状态。
除了INI-822,Boehringer Ingelheim针对HSD17B13也开发了一款小分子抑制剂BI-3231,尽管其活性有1nM,与同族HSD17B11相比,选择性也提高了一万倍,但是在体内PK上,BI-3231的清除率高、暴露量低和半衰期低,这让其止步于先导化合物。
4. 关于缔码
缔码生物科技有限公司是一家专注于可成药靶点临床前研发产品和服务的生物技术公司。公司计划在未来的3-5年完成所有可成药靶点的预制先导抗体分子的制备,让药企跨过单抗平台建立和先导抗体分子筛选的门槛,有更多的时间聚焦于药靶的生物学机制和可成药性研究,从而更快地推进临床管线。缔码四大技术平台:
- DiMProTm功能性膜蛋白开发平台 (ECD,Synthetic Nanodisc,VLP);
- 缔码单克隆抗体单B细胞先导抗体分子发现平台(3年内已经完成300+ 药靶,5000+兔单抗分子的开发)
- DiLibraryTM抗体工程改造平台(抗体人源化、抗体亲和力成熟、PTM去除等)
参考文献:
[1]Liu S, Huang C, Li D, Ren W, Zhang H, Qi M, Li X, Yu L. Molecular cloning and expression analysis of a new gene for short-chain dehydrogenase/reductase 9. Acta Biochim Pol. 2007;54(1):213-8. Epub 2007 Feb 20.
[2]Zhang HB, Su W, Xu H, Zhang XY, Guan YF. HSD17B13: A Potential Therapeutic Target for NAFLD. Front Mol Biosci. 2022 Jan 7;8:824776.
[3]Anstee QM, Darlay R, Cockell S, et al. Genome-wide association study of non-alcoholic fatty liver and steatohepatitis in a histologically characterised cohort☆. J Hepatol. 2020 Sep;73(3):505-515.
Su W, Peng J, Li S, Dai YB, Wang CJ, Xu H, Gao M, Ruan XZ, Gustafsson JÅ, Guan YF, Zhang XY. Liver X receptor α induces 17β-hydroxysteroid dehydrogenase-13 expression through SREBP-1c. Am J Physiol Endocrinol Metab. 2017 Apr 1;312(4):E357-E367.