抗体偶联药物(Antibody-drug conjugates,ADC)主要由单克隆抗体、连接子和细胞毒素(又称为有效载荷或Payload)三部分构成。其中抗体作为ADC药物的“导弹”,具有靶向功能,可以特异性识别肿瘤细胞表面抗原,与细胞表面抗原结合后发生内吞,将细胞毒素带到肿瘤细胞并发挥毒性效应。由于一些抗体与抗原结合后不一定会被靶细胞内吞,所以抗体内化能力是ADC药物早期筛选的一项重要指标。那抗体内化的原理是什么?作用途径有哪些?影响抗体内化的因素又有哪些?目前抗体内化的检测方法又有哪些呢?
1、抗体内化原理及途径
如前所述,抗体内化,也可以理解为抗体内吞,是指在细胞表面的抗体与相应的抗原结合后,通过自身分子运输体系,将抗体和抗原复合物带入细胞内部,并在内部起到特定的生物学作用。抗体内化是大多数ADC药物分子进入细胞的方式。常规内吞作用可分为三个阶段:芽形成;膜弯曲和囊泡成熟;以及膜分裂并释放到细胞质中。通过对当前已上市ADC药物内化方式的分析(如下图所示),ADC药物内化途径可根据是否依赖网格蛋白分为两类:一是网格蛋白介导的内吞作用(CME);二是网格蛋白非依赖性内吞作用。其中,网格蛋白非依赖性内吞作用会进一步分为小窝蛋白介导的内吞作用、小窝蛋白非依赖性载体蛋白/GPI锚定蛋白富集的早期内体区室 (CLIC/GEEC) 和巨胞饮作用。
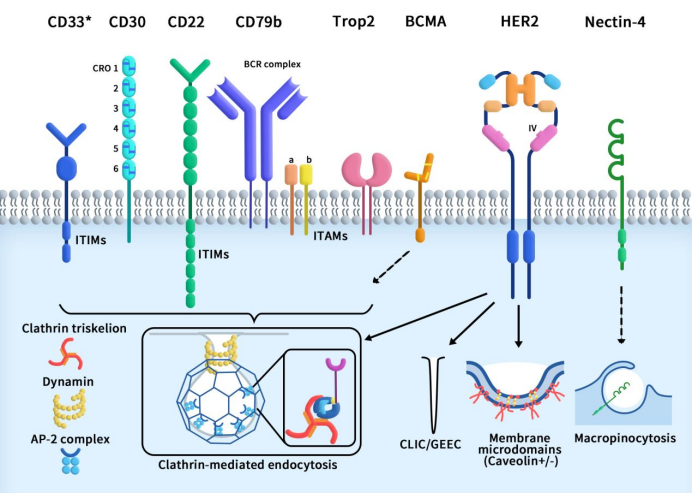
Figure 1. collection of endocytosis pathways utilized by the target antigens for the currently approved ADCs [1]
这里我们重点介绍一下ADC药物内吞的主要途径-网格蛋白介导的内吞作用。网格蛋白介导的内吞作用包括一些连续且部分重叠的步骤。不同受体的CME触发机制并不一样。CME可以由质膜上的某些受体组成型启动,也可以通过受体与配体和/或抗体结合来启动。当细胞质里的内吞衣壳蛋白开始在质膜内小叶上聚集时,CME就开始了。衣壳蛋白通过从细胞质中募集额外的接头蛋白并与其相互作用来继续组装和生长。关键的衔接蛋白使膜弯曲,从而将内化受体/配体聚集到“网格蛋白包被坑”(CCP)中。由于CCP内陷变大,CCP颈部会收缩,继而通过一个断裂过程与质膜分离。肌动蛋白聚合有助于将CCP“向内”拉入细胞质,直到分裂完成,CCP被释放并成为网格蛋白包被的囊泡(CCV)。最后,CCV外壳被分解,CCV 与内体融合并分选到特定的亚细胞位或循环回到细胞表面 [1]。
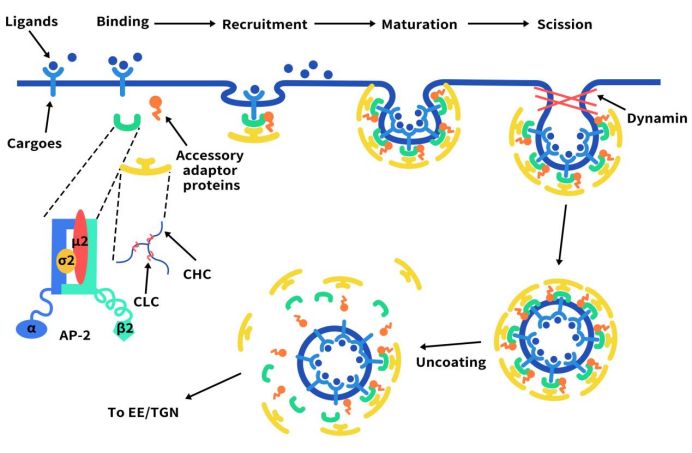
Figure 2. The mechanism of Clathrin-mediated endocytosis
2、影响抗体内化的因素有哪些
抗体是否能被内化主要由靶点决定,而抗体内化的效率受到多方面因素的影响,主要因素包括抗体的亲和力和特异性、抗体的类型和亚型、抗体的剂量和浓度及细胞的类型和状态。
抗体的亲和力和特异性:亲和力高的抗体能更有效地与抗原结合,促进内化。特异性高的抗体能更精确地识别抗原,避免非特异性结合。
抗体的类型和亚型:不同类型和亚型的抗体有不同的受体和信号通路,影响内化的速度和效率。例如,IgG和IgA的内化速度较快,而IgM和IgE的内化速度较慢。
抗体的剂量和浓度:抗体的剂量和浓度越高,与抗原的结合越多,内化的可能性越大。但是,过高的抗体剂量和浓度也可能导致受体饱和或下调,降低内化的效果。
细胞的类型和状态:不同类型的细胞有不同的受体表达和内化能力,影响抗体内化的差异。细胞的状态也会影响内化的动力学,例如,活化的细胞内化速度较快,而凋亡的细胞内化速度较慢。
此外,分子量较大的抗原通常更难被细胞内化,而且,哪怕同一靶点的不同抗体也会表现出不同的内化效率。所以,在ADC药物研发过程中,筛选出高内化效率的抗体是安全性的重要保证。
3、如何检测抗体内化
有多种常规方法用于抗体检测内化。根据检测实验类型可分为四大类,包括基于活细胞成像的内化检测、基于毒素偶联的杀伤检测、基于pH探针的内化检测和基于温度转变的荧光二抗内化检测。
基于活细胞成像的内化检测也称为Incucyte,是通过实时活细胞成像仪对裸抗进行药效动力学的实时检测。不同于终点检测,它是多浓度点、多时间点模式抗体内化检测的最佳选择。可对活细胞实时观察,连续检测可长达72小时。
基于毒素偶联的杀伤检测主要包括两种方法,一种是DT3C法,一种是Mab-ZAP方法。二者都是通过抗体-毒素复合物在细胞内释放毒素然后引发细胞毒性。然后通过检测细胞杀伤来评估抗体的内化效果。DT3C是2014年MikiYamaguchi等人通过基因重组技术生产的一种重组蛋白,由一个没有受体结合域的白喉毒素(DT)和链球菌蛋白G的C1、C2、C3 (3C)结构域组成。Mab-ZAP由小鼠抗体和核糖体失活蛋白皂草素组成。与传统的Mab-ZAP方法相比,DT3C法中mAb-DT3C偶联物分子量更稳定,内化效率更高,适用性更广,成本更低。
基于PH探针的内化检测和基于温度转变的荧光二抗内化检测是两种常用的检测细胞内化过程的方法,它们都有各自的优缺点。基于PH探针的内化检测是利用荧光探针对pH值的敏感性,来反映细胞内囊泡的酸化程度,从而判断内化的进程和位置。基于温度转变的荧光二抗内化检测是利用荧光二抗在不同温度下的荧光强度变化,来区分细胞内外的荧光信号,从而判断内化的效率和程度。两种方法的优缺点如下:
| 基于PH探针的内化检测 | 基于温度转变的荧光二抗内化检测 | |
| 优点 | 方法简便,操作方便,无需复杂的仪器和试剂; 荧光信号清晰,可定量分析,适用于高通量筛选; 可用于多种细胞类型和多种荧光标记物,如抗体、配体、药物等。 | |
| 缺点 | 需要选择合适的pH敏感探针,以匹配不同的内化通路和目标; 不同的pH探针有不同的pH响应范围和灵敏度,也有不同的荧光性质和稳定性; pH探针可能会受到其他因素的干扰,如细胞内其他荧光物质、细胞内外的缓冲系统等。 | 需要控制好温度的变化,以保证荧光信号的可靠性; 不同的荧光二抗有不同的温度敏感性,也有不同的荧光性质和稳定性; 温度转变可能会影响细胞的生理状态和内化的动力学,也可能会影响荧光标记物的结合和释放等。 |
4、缔码pH敏感试剂助力抗体内化检测
由缔码研发的DiTag PH敏感IgG标记试剂提供了一种易于测试抗体内吞的解决方案。这两款试剂(AME100001和AME100002)利用PH敏感荧光标记的Fc结合蛋白与来自不同物种的IgG抗体结合,导致荧光标记抗体-试剂复合物的形成。抗体内吞后,周围PH变为酸性,抗体和标记试剂复合物的荧光信号明显增强。荧光强度的强弱可以直接反应抗体内吞的效率。通过测量荧光信号强度,研究人员可以评估抗体内吞效率。两款产品的主要区别在于特异性标记的IgG亚型,如下表所示:
| AME100001 | AME100002 | |
| specific IgG types | Human IgG1, IgG2, and IgG4 Rabbit IgG Mouse IgG2a and IgG2b | Human IgG1, IgG2, IgG3, and IgG4 Rabbit IgG Mouse IgG1, IgG2a, IgG2b, and IgG3 |
·DiTagTM pH sensitive IgG labeling reagent (AME100001)
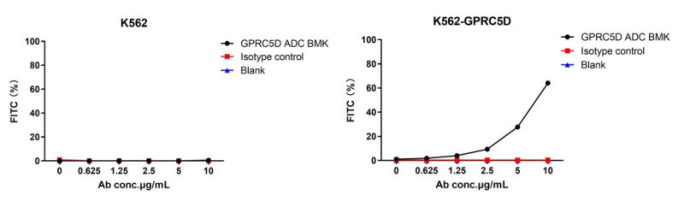
Figure 3. The fluorescent signal from GPRC5D ADC BMK-AME100001 conjugate is only detected in GPRC5D positive cells (K562-GPRC5D stable expression cell line), indicating specific internalization.
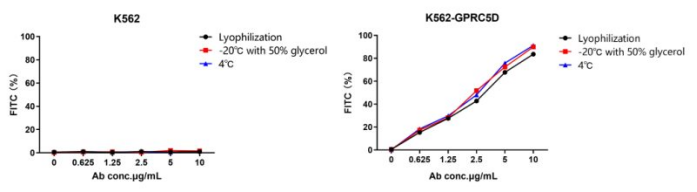
Figure 4. Stability test of AME100001. Three storage methods are tested: lyophilization and reconstitution (black), liquid with 50% glycerol at -20℃ (red), liquid at 4℃ (blue). All three methods exhibit excellent stability.
·DiTagTM pH sensitive IgG labeling reagent plus (AME100002)
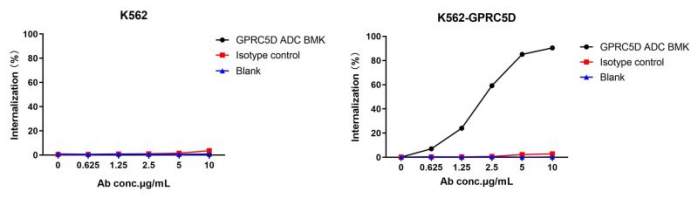
Figure 5. The fluorescent signal from GPRC5D ADC BMK-AME100002 conjugate is only detected in GPRC5D positive cells (K562-GPRC5D stable expression cell line), indicating specific internalization.
参考文献:
[1] Hammood M, Craig AW, Leyton JV. Impact of Endocytosis Mechanisms for the Receptors Targeted by the Currently Approved Antibody-Drug Conjugates (ADCs)-A Necessity for Future ADC Research and Development. Pharmaceuticals (Basel). 2021 Jul 15;14(7):674.


